
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。

请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________。
(2)实验仪器:①________;②________;③________;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①________;②________;③________;④________;⑤________;⑥________。
(5)写出实验操作②、⑥中有关反应的离子方程式:
实验②________________________,实验⑥______________________。
(6)实验结论:__________________________。
【答案】探究同周期元素性质的递变规律 试管 烧杯 酒精灯 B F A D C E Cl2+H2S===2HCl+S↓ Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O 金属性:Na>Mg>Al;非金属性:Cl>S(或同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强)
【解析】
结合元素金属性强弱和非金属性强弱判断方法,从Na、Mg、Al与水、酸反应的难易及Al(OH)3的两性分析,探究同周期元素性质递变规律;
(1)根据实验方案可知实验目的;
(2)根据仪器的用途确定实验仪器;
(4)根据生成物的颜色、状态、溶液的酸碱性选取相应的实验现象;
(5)②氯气氧化硫化氢生成硫和氯化氢;⑥向AlCl3溶液中滴加NaOH溶液,先生成Al(OH)3沉淀,再继续滴加沉淀溶解;
(6)根据实验来分析实验的结论。
(1)实验目的是:探究同周期元素的金属性和非金属性的递变规律;
(2)钠与滴有酚酞试液冷水反应的实验,常在烧杯中进行;镁带与2 mol·L-1的盐酸反应的实验,常在试管中进行;铝条与2 mol·L-1的盐酸反应的实验,常在试管中反应,向氯化铝溶液滴加氢氧化钠溶液需用胶头滴管;
(4)①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞,其现象应是:有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色(选B);
②向新制的硫化氢饱和溶液中滴加新制的氯水,氯气会将硫离子氧化为单质硫,出现黄色沉淀(选F);
③钠与滴有酚酞试液的冷水反应,反应方程式是2Na+H2O===2NaOH+H2↑,其离子方程式是2Na+H2O===2Na-+2OH-+H2↑,其现象应该是:浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色(选A);
④镁带与2mol·L-1盐酸剧烈反应,产生的气体可以在空气中燃烧(选D)。值得注意的是镁比铝活泼,因此与盐酸反应,镁比铝剧烈;
⑤铝条与2mol·L-1的盐酸反应,其化学方程式是2Al+6HCl===2AlCl3+3H2↑,即离子方程式是2Al+6H+===2Al3++3H2↑,其现象是:反应不十分剧烈,产生的气体可以在空气中燃烧(选C);
⑥向氯化铝溶液中滴加氢氧化钠溶液至过量,其现象:生成氢氧化铝白色胶状沉淀,继而在氢氧化钠过量时氢氧化铝与氢氧化钠反应使沉淀消失(选E);
(5)②发生反应的离子方程式为Cl2+H2S=S↓+2H++2Cl-;⑥向AlCl3溶液滴加NaOH溶液至过量,可观察到先有白色胶状的Al(OH)3沉淀生成,后继续滴加沉淀溶解,Al(OH)3与NaOH反应生成NaAlO2和水,涉及反应的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;
(6)由实验可知金属性Na>Mg>Al,非金属性Cl>S,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强。


科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:

(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100ml同物质的量浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定):
① | ② | ③ | ④ | |
铝热剂质量/g | 5g | 10g | 15g | 20g |
气体体积/L | 2.24L | 4.48L | 6.72L | 6.72L |
试完成下列计算:
(1)NaOH溶液的物质的量浓度_______________。
(2)该铝热剂中铝的质量分数_____________
(3)20g该铝热剂发生铝热反应理论上产生铁的质量是多少?________(写出步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①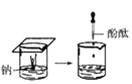 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②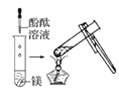 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③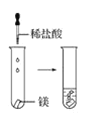 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④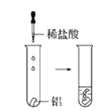 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
A.SiO2具有导电性,可用于制作光导纤维和光电池
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.乙酰胺(![]() )与甘氨酸的化学性质相同
)与甘氨酸的化学性质相同
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为___。
(2)已知下列热化学方程式
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -25kJ·mol-1 ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -47kJ·mol-1 ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= +19kJ·mol-1 ③写出FeO(s)被CO还原成Fe和CO2的热化学方程式____。
(3)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl22CO2H2O
(1)X基态原子的电子排布式为______.
(2)C、H、O三种原子的电负性由大到小的顺序为______.
(3)X2Cl22CO2H2O是一种配合物,其结构如图1所示:
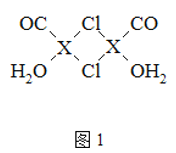
①与CO为互为等电子体的分子是______.
②该配合物中氯原子的杂化方式为______.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______.
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______.XCl的化学式__________
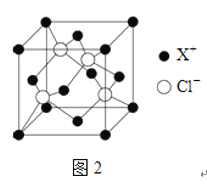
已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加德罗常数NA=_____________(无需化简,列式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com