
| A、混合物:盐酸、生铁、空气 |
| B、化合物:CaCl2、NaOH、HCl |
| C、碱:苛性钠、纯碱、氢氧化钾 |
| D、单质:Ca、O3、石墨 |


科目:高中化学 来源: 题型:
| A、C3H8中碳原子都采用的是sp3杂化 |
| B、O2、CO2、N2都是非极性分子 |
| C、酸性:H2CO3<H3PO4<H2SO4<HClO |
D、CO的一种等电子体为NO+,它的电子式为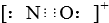 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的物质的量浓度为1 mol?L-1 |
| B、该溶液中含有35.5 g Na2SO4 |
| C、配制100 mL该溶液需用7.1 g Na2SO4 |
| D、量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定前 | 滴定后 | |
| 第一次 | 0.70 | 16.15 |
| 第二次 | 0.05 | 16.35 |
| 第三次 | 0.35 | 15.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com