
【题目】A、B、C、D是高中阶段学习的四种物质,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C、D是刚学过的两种有重要用途的物质,化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由一种活泼金属与氧气燃烧得到。回答下列问题:
(1)单质A与单质B反应的化学方程式:__________。
(2)单质B与水反应的化学方程式:_____________。
(3)D用于呼吸面具中,发生反应的化学方程式:_________。
(4)C与NaOH溶液反应的化学方程式:_____。
【答案】H2+Cl2![]() 2HCl Cl2+H2O=HCl+HClO 2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O =4NaOH+O2↑ HClO+NaOH=NaClO+H2O
2HCl Cl2+H2O=HCl+HClO 2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O =4NaOH+O2↑ HClO+NaOH=NaClO+H2O
【解析】
根据单质A在单质B中燃烧产生苍白色的火焰可知A为H2,B为Cl2;根据化合物D是淡黄色物质,可用于呼吸面具可知D为Na2O2,根据化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一可知C为HClO。
(1)氢气在氯气中燃烧生成氯化氢,反应的化学方程式为H2+Cl2![]() 2HCl,故答案为:H2+Cl2
2HCl,故答案为:H2+Cl2![]() 2HCl;
2HCl;
(2)氯气和水反应生成生成盐酸和次氯酸,反应的化学方程式为Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(3)过氧化钠能与人呼吸出的二氧化碳和水反应生成氧气,可供人呼吸,常用于呼吸面具中,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O =4NaOH+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O =4NaOH+O2↑;
(4)HClO是弱酸,能与NaOH溶液发生中和反应生成次氯酸钠和水,反应的化学方程式为HClO+NaOH=NaClO+H2O,故答案为:HClO+NaOH=NaClO+H2O。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是

A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件己略去)。A是由两种元素组成的难溶于水的物质,摩尔质量为88 g·mol-l;B是常见的强酸;C是一种气态氢化物;气体E能使带火星的木条复燃;F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN试剂,溶液出现血红色。请回答下列问题:

(1)G的化学式为_________________________。
(2)C的电子式为________________________。
(3)写出反应①的离子方程式:_____________________。
(4)写出反应②的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、氧化铜、稀硫酸、氢氧化钠溶液和硫酸铜溶液五种物质构成了如下图所示的关系网络(图中的“——”表示相连的两种物质常温下能发生反应)。下列说法不正确的是( )
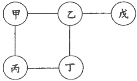
A.甲可能为氢氧化钠溶液B.乙可以使紫色石蕊溶液变红
C.丙和丁的反应一定是置换反应D.戊一定是氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A. 在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 当溶液的pH为7时,溶液的总体积为20 mL
C. 在B点所示的溶液中,浓度最大的阳离子是Na+
D. 在 A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500°C时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵晶体隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________________
(2)为检验分解产物的成分,设计如下实脸装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是_______________________________。
②为检验A中残留物是否含有FeO,需要选用的试剂有______________(填标号)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)通入酸性高锰酸钾溶液,溶液褪色,该反应中SO2表现出化学性质是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的描述正确的是( )
A.甲烷是最简单的有机物,也是含碳量最高的有机物
B.甲烷是一种无色无味,密度比空气小,易溶于水的气体
C.甲烷是天然气、坑道气、沼气的主要成分
D.甲烷性质不活泼,除可燃外,不与其他物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,若A容器中充满气体O2和B容器中充满气体O3
(1)若所含分子总数相等,则A容器和B容器的容积之比是____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是____。
(3)若两容器的体积比为3:2,则O2和O3物质的量之比为____,质量之比为____,密度之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com