
【题目】根据下图所给信息,得出的结论正确的是
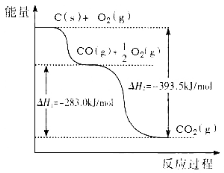
A.48g碳完全燃烧放出热量为1574 kJ/mol
B.2C(s)+O2(g)![]() 2CO(g) △H=-221.0kJ/mol
2CO(g) △H=-221.0kJ/mol
C.2CO2(g)![]() 2CO(g)+O2(g) △H=+283.0kJ/mol
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g)![]() CO2(s) △H=-393.5kJ/mol
CO2(s) △H=-393.5kJ/mol
【答案】B
【解析】
试题A.根据图示可知,1mol的C完全燃烧放出热量是393.5KJ,则48g碳也就是4mol的碳完全燃烧放出热量为393.5KJ /mol×4=1574 kJ,错误;B.1mol的 C燃烧变为CO,放热为393.5KJ-283KJ=110. 5KJ,则2mol的C燃烧变为CO放出热量是:110. 5KJ×2=221.0kJ,所以有热化学方程式2C(s)+O2(g)== 2CO(g) △H=-221.0kJ/mol,正确;C.根据图示可知1mol的CO2比1mold CO和1/2mold O2的能量低283.0kJ,则相应的热化学方程式是2CO2(g)== 2CO(g)+O2(g) △H=+566.0kJ/mol,错误;D.1mol的固体C完全燃烧产生1mol的气体CO2,放出热量是393.5kJ ,由于物质在固体含有的能量比气态低,所以产生1魔力岛固态CO2放出的热量要比393.5kJ 多,因此该热化学方程式书写有误,错误。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学小组在查阅文献及实验探究的基础上,深刻地认识了卤素的性质。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式_____________________________________。
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HC1溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为_________________________________________________。
(3)停止加热后的操作是____________________________________,再将管6和管7拆下。
(4)查阅文献资料知道,将NaC1O溶液加热,NaC1O分解可生成NaC1O3,据此推断若将KC1O3加热至673K,其分解的化学方程式为_____________________________________。
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17

第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一只试管中。
(5)已知![]() ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(![]() )。
)。
(6)根据上述计算,可推知清液中溶质主要成分的化学式为_________________________。
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是_______________________________________________,证实C1-存在。反应的离子方程式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。

实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )

A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. S![]() SO3
SO3![]() H2SO4
H2SO4
B. NH3![]() NO2
NO2![]() HNO3
HNO3
C. Cu2(OH)2CO3![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
D. 饱和NaCl溶液![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I- ![]() 2Fe2++I2设计成如图所示的原电池。回答下列问题:
2Fe2++I2设计成如图所示的原电池。回答下列问题:
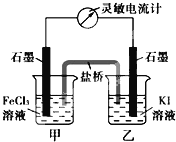
(1)反应开始时,乙中石墨电极上发生________反应(填“氧化”或“还原”),盐桥中的阴离子移向________(填“甲”或“乙”)烧杯。
(2)反应开始时,甲中石墨电极上的电极反应式为________。
(3)反应达到化学平衡状态时,电流计指针________偏转。(填“是”或“否”)。
(4)反应达到平衡状态后,在甲中溶入FeCl2固体,乙中石墨电极为________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
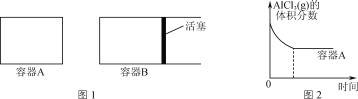
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
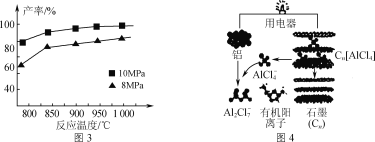
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置适合于( )

A.用浓硝酸与Cu反应制取NO2B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2D.用NH4Cl和Ca (OH)2反应制取NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com