
| A、3种溶液pH的大小顺序是 ③>②>① |
| B、若分别滴加25mL和上述溶液等浓度的盐酸后,pH最大的是① |
| C、若将3种溶液稀释相同倍数,pH变化最大的是② |
| D、若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
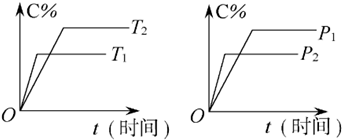
| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,化学平衡常数是一个恒定值 |
| B、从平衡常数K的大小可以推断一个反应进行的程度 |
| C、平衡常数K只与温度有关,与反应起始浓度、压强无关 |
| D、改变反应物浓度或生成物浓度都会改变平衡常数K |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配合物中必定存在配位键 |
| B、配合物中只有配位键 |
| C、[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
| D、配合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在纯水中加入能水解的盐一定促进水的电离 | ||
| B、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | ||
C、加热CH3COONa溶液,溶液中
| ||
| D、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
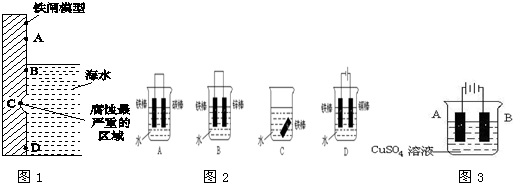
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O═2NaOH+H2↑ |
| B、2F2+2H2O═4HF+O2↑ |
| C、SO2+H2O═H2SO3 |
| D、Cl2+H2O═HCl+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com