
【题目】将标准状况下,体积为VL的某气体(摩尔质量为Mg/mol)溶于0.1L水中(设水的密度为lg/mL),所得溶液密度为pg/mL,溶液的物质的量浓度为c(mol/L),质量分数为ω,则下列关系中正确的是 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】
气体物质的量为V/22.4mol,气体的质量为MV/22.4g;体积为VL的某气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液质量为:MV/22.4+0.1×1000=(MV/22.4+100)g;该溶液的体积为:(MV/22.4+100)/p mL=(MV/22.4+100)/1000pL;
A.该溶液的质量分数为:(MV/22.4)/(MV/22.4+100)×100%= MV/( MV+2240) ×100%,A错误;
B. 根据c=n/V= V/22.4/[(MV/22.4+100)/1000p]= 1000ρV/( MV+2240)mol/L,B错误;
C. 该溶液的质量分数为:(MV/22.4)/(MV/22.4+100)×100%= MV/( MV+2240) ×100%,C错误;
D.根据C选项可知,质量分数为ω= MV/( MV+2240) ×100%,所以根据c=n/V=V/22.4/[(MV/22.4+100)/1000p]= 1000ρω/M,D正确;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】下列文字表述与反应的离子方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C. 苯酚与纯碱溶液混合:2C6H5OH + CO32- ![]() CO2 ↑+ H2O + 2C6H5O-
CO2 ↑+ H2O + 2C6H5O-
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4Ag(NH3)2++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
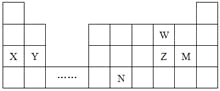
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯 E 和高分子化合物 H 的示意图如下所示:
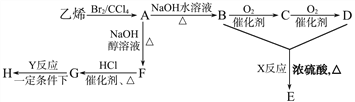
请回答下列问题:
(1)写出以下反应的反应类型:X_______,Y________。
(2)写出以下反应的化学方程式:
A→B:__________;G→H:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
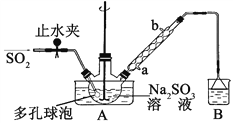
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从_____(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是__________________________________________。
(3)冷凝管中回流的主要物质除H2O 外还有________ (填化学式)。
(4)写出步骤2中发生反应的化学方程式________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是____________________________。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NaHSO4是一种酸式盐。2mol/L的NaHSO4溶液与1mol/L的Ba(OH)2溶液等体积混合,反应的离子方程式为__________________________。
(2)写出Na与FeCl3溶液的反应的离子反应方程式:_________________________________
(3)乙同学检测到该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
n(Cl﹣) | 2.5mol | 3.5mol | 4.0mol |
n(Br﹣) | 3.0mol | 2.5mol | 2.0mol |
n(I﹣) | x mol | 0 | 0 |
原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制80 mlL1.00 mol/LNaCl溶液,实验室现有含有少量碳酸钠的氯化钠固体。
Ⅰ.为了除去氯化钠样品中的杂质,某兴趣小组最初设计了如下方案进行实验:
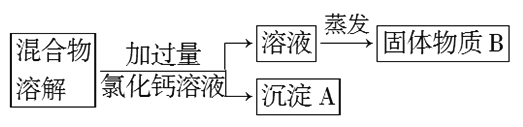
(1)沉淀A的化学式是_______________。
(2)在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。则固体物质B的成分为_________________(用化学式表示)。
(3)继续探究后又提出了新的方案:将混合物溶解,先滴加足量_________________(填试剂名称),再蒸发结晶,有关反应的离子方程式为_______________________________。
Ⅱ.配制溶液:
(1)配制过程中需要使用的玻璃仪器除烧杯和玻璃棒外还有_________________。
(2)从所配溶液中取出10mL,与足量AgNO3溶液反应,经过滤、洗涤、干燥后得到白色沉淀1.50 g。则所配溶液的浓度________1.00 mol/L (填“>”、“<”或“=”),造成此误差的操作可能是_______________。
A.使用容量瓶前未干燥
B.用托盘天平称量氯化钠固体时将砝码错放在左盘
C.定容时俯视容量瓶的刻度线
D.定容后经震荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com