
【题目】实验室要配制80 mlL1.00 mol/LNaCl溶液,实验室现有含有少量碳酸钠的氯化钠固体。
Ⅰ.为了除去氯化钠样品中的杂质,某兴趣小组最初设计了如下方案进行实验:
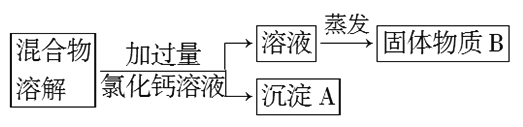
(1)沉淀A的化学式是_______________。
(2)在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。则固体物质B的成分为_________________(用化学式表示)。
(3)继续探究后又提出了新的方案:将混合物溶解,先滴加足量_________________(填试剂名称),再蒸发结晶,有关反应的离子方程式为_______________________________。
Ⅱ.配制溶液:
(1)配制过程中需要使用的玻璃仪器除烧杯和玻璃棒外还有_________________。
(2)从所配溶液中取出10mL,与足量AgNO3溶液反应,经过滤、洗涤、干燥后得到白色沉淀1.50 g。则所配溶液的浓度________1.00 mol/L (填“>”、“<”或“=”),造成此误差的操作可能是_______________。
A.使用容量瓶前未干燥
B.用托盘天平称量氯化钠固体时将砝码错放在左盘
C.定容时俯视容量瓶的刻度线
D.定容后经震荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
【答案】CaCO3 NaCl、CaCl2 CO32-+2H+===H2O+CO2↑ 盐酸 100mL容量瓶、胶头滴管 > C
【解析】
Ⅰ.(1)加入氯化钙与混合溶液中的碳酸钠反应,生成CaCO3沉淀;
(2)由于加入过量的氯化钙,所以滤液为氯化钠和氯化钙的混合溶液,蒸发后得到固体为氯化钠和氯化钙;故答案为:NaCl、CaCl2;
(3)若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,发生的化学的离子方程式为CO32-+2H+=H2O+CO2↑;
Ⅱ.(1)实验室没有80 mL规格的容量瓶,必须配制100mL 2mol/L的NaCl溶液,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,故需要仪器有:天平、药匙、玻璃棒、胶头滴管、烧杯和100mL容量瓶,故配制过程中需要使用的玻璃仪器除烧杯和玻璃棒外还有:100mL容量瓶、胶头滴管;
(2)根据反应Ag++Cl-=AgCl↓可知,n(Cl-)=n(Ag+)=![]() =0.0104mol,则所配溶液的浓度=
=0.0104mol,则所配溶液的浓度=![]() 1.00 mol/L ;
1.00 mol/L ;
A.使用容量瓶前未干燥,由于定容时需加入蒸馏水,对浓度无影响,选项A不符合;
B.用托盘天平称量氯化钠固体时将砝码错放在左盘,所称氯化钠偏少,配得溶液浓度偏低,选项B不符合;
C.定容时俯视容量瓶的刻度线,所加蒸馏水的量偏少,配得溶液浓度偏高,选项C符合;
D.定容后经震荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,则蒸馏水加多了,配得溶液浓度偏低,选项D不符合。
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将标准状况下,体积为VL的某气体(摩尔质量为Mg/mol)溶于0.1L水中(设水的密度为lg/mL),所得溶液密度为pg/mL,溶液的物质的量浓度为c(mol/L),质量分数为ω,则下列关系中正确的是 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
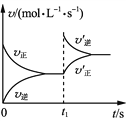
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列物质所含分子数最少的是
A. 6 mol CO2 B. 6g氢气 C. 标准状况下,224L氨气 D. 含氧分子数为4NA的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
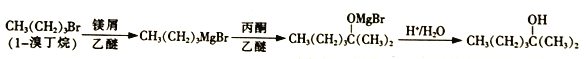
已知:RMgBr化学性质活泼,易与H2O、R'X等发生反应生成RH、R-R'。
(1)仪器A的名称是___________。
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是_____,若镁屑不足,则反应时生成的有机副产物为________(填结构简式)。

(3)干燥管中无水氯化钙的作用为__________。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为_________。
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为![]() ,则两者的关系正确的是( )
,则两者的关系正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】试题分析:醋酸是弱酸,存在电离平衡,稀释促进电离。所以pH为2和3的CH3COOH溶液的浓度前者大于后者的10倍,所以中和等物质的量的氢氧化钠消耗醋酸溶液的体积应该是![]() ,答案选D。
,答案选D。
考点:考查弱电解质的电离以及外界条件对电离平衡的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。
【题型】单选题
【结束】
22
【题目】某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
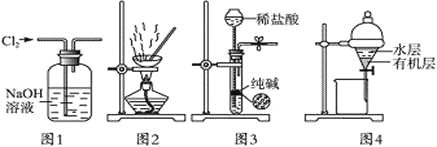
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
I.SO2的制取和部分性质研究。
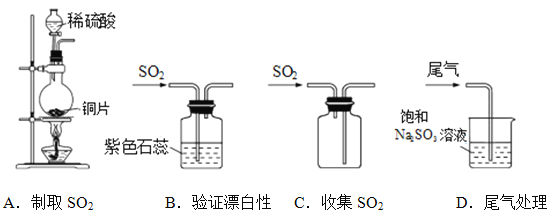
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是____________
(2)设计实验验证SO2与Fe2+ 还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_________溶液,观察到_____________, 可知混合液中无Fe3+;
向乙中滴加_________溶液,观察到______________,可知混合液中有__________由此得出结论:SO2的还原性强于Fe2+ 。
II.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或HSO3-。设计如图1的实验:
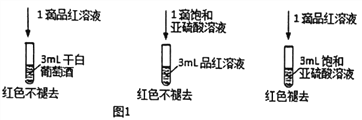
甲同学得出实验结论:干白葡萄酒中不含SO2或HSO3-。这个结论是否合理_____(填“是”或“否”)说明理由__________________________________________。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
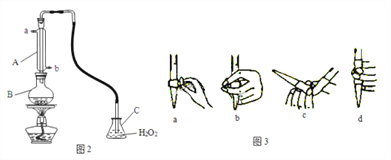
实验步骤:
i. 检查装置的气密性后,向图2仪器B中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与C中H2O2完全反应
iii. 除去C中过量的H2O2
iv. 用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①仪器A的名称是____,A的进水口为____,滴定前排气泡时,应选择图3中的___。
②C中反应生成物的化学式是________,除去过量H2O2的方法是_________________。
③滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为____g/L,是否符合国家标准________(填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是______________。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com