
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
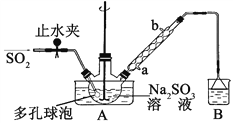
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从_____(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是__________________________________________。
(3)冷凝管中回流的主要物质除H2O 外还有________ (填化学式)。
(4)写出步骤2中发生反应的化学方程式________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是____________________________。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为_____。
【答案】 NaOH溶液 a 增大气体与溶液的接触面积,加快气体的吸收速率 HCHO NaHSO3+HCHO+Zn+H2O= NaHSO2HCHO+Zn(OH)2 防止温度过高使产物分解,也防止氧气将产物氧化 77%
【解析】试题分析:(1)该实验是以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛,SO2作为尾气不能排放到空气中,装置B的作用是吸收SO2,所以装置B 的烧杯中应加入的溶液是NaOH溶液,A为三颈烧瓶, 冷凝水从下口进水,才有利于冷水在冷凝器中存在,冷凝效果更好;所以冷却水从a口进水。
(2)为了增大气体与溶液的接触面积,加快气体的吸收速率,A中放置了多孔球泡。
(3)HCHO具有挥发性,在80℃—90℃条件下会大量挥发,加冷凝管可以是HCHO冷凝回流提高HCHO的利用率。
(4)该实验是以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛,则步骤2中发生反应的化学方程式为NaHSO3+HCHO+Zn+H2O= NaHSO2HCHO+Zn(OH)2。
(5)次硫酸氢钠甲醛具有还原性,在敞口容器中蒸发浓缩,可以被空气中的氧气氧化变质,为了防止温度过高使产物分解,也防止氧气将产物氧化,在真空容器中进行蒸发浓缩。
(6)根据题意发生的离子反应为2H2O+HSO2-+2I2=SO42-+4I-+5H+,SO42-+Ba2+=BaSO4↓,得关系式为
NaHSO2HCHO2H2O—BaSO4
154 233
x 0.466 列方程解得:x=0.308
则所制得的产品的纯度为(0.308×5)÷2.0×100%=77%。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】一份溶液中可能大量含有K+、A13+、H+、NH4+、Cl-、Br-、I-、ClO-、A1O2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示:
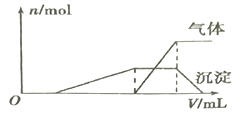
则该溶液中一定存在的离子是________,一定不大量存在的离子是__________。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-、与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
Cl2的体积(标准状况下) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
当通入的氯气为2.8L(标准状况下)时,溶液中发生反应的离子方程式为___________,原溶液中n(Cl-)为____mol;通入氯气的体积在2.8L~5.6L(标准状况下)之间时的有关离子方程式为(如有多个反应,请分开书写)_________________,原溶液中Cl-、Br-、I-的物质的量浓度之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验,请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是_______________________________________,此时锥形瓶内溶液的pH为________。
②根据上述数据,可计算出该盐酸的浓度约为____________________(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或性质与应用均正确的是( )
A. Al2O3的熔点很高,可用于制作耐高温材料
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. 硅晶体是良好的半导体,可用于制造光导纤维
D. Al(OH)3是一种强碱,可以与酸反应,可用作医用的胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为__________________,若A原子的最外层电子排布为1s1,则按原子轨道的重叠方式判断,A与C形成的化合物中的共价键类型属于______键。
(2)上述化合物A2C的熔沸点高于化合物DA3的熔沸点,其主要原因可能是____________;
(3)当n=2时,B与C形成的晶体属于 _______晶体,B与C形成的最高价化合物的结构式为_________________ 。
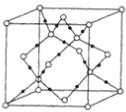
(4)当n=3时,B与C形成的晶体属于_______晶体,其晶体结构如下图所示。该晶体中最小的环由______个微粒构成,一个晶胞中含有______个B微粒,______个C微粒。
(5)若A原子的最外层电子排布为4s1,B原子的价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为 _______________________ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下发生反应:2X(g)![]() Y(g)+3Z(g) △H=akJ·mol-1(a>0)下列说法正确的是
Y(g)+3Z(g) △H=akJ·mol-1(a>0)下列说法正确的是
A. 增大X的浓度,正反应速率增大,逆反应速率减小
B. 将0.2molX充入反应器中,充分反应后,生成的Z的物质的量可能为0.09mol
C. 达到化学平衡状态时,正、逆反应的速率都为0
D. 达到化学平衡状态时,共吸收a kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活处处有化学。下列说法正确的是( )
A. 制饭勺、饭盒、高压锅等的不锈钢是合金
B. 做衣服的棉和麻均与淀粉互为同分异构体
C. 煎炸食物的花生油和牛油都是高分子化合物
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:
(1)装置A是用来制取氯气的,若烧瓶中盛放的是漂白粉,分液漏斗中是浓盐酸①配平该反应的化学方程式:
Ca(ClO)2+()═Cl2↑+CaCl2+()
②装置A中g管的作用是 .
(2)装置D中放有一块红色的纸条,一半用水润湿,一半干燥.实验过程中发现,湿润的部分很快褪色了,又过了一段时间,整块纸条全部褪色.某同学认为是因为装置D中下半部分氯气浓度大于上半部分,这种解释是否合理?(填“合理”或“不合理”),若不合理请说明真正的原因:(若填合理则此空不答).
(3)反应一段时间后用注射器从E中抽取少量溶液,检验出有Fe3+生成,请写出该反应的化学方程式:
(4)该装置缺少尾气处理装置,根据所学知识写出尾气处理的化学方程式: . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com