
【题目】下列物质是电解质的是
A.硅单质B.酒精C.硝酸钾D.二氧化硫
科目:高中化学 来源: 题型:
【题目】有机物M是一种常用香料2的主要成分之一,由烃A合成其路线如下。
己知:①B的结构简式为:![]()
②RC≡CH+HCHO![]() RC≡CCH2OH;
RC≡CCH2OH;
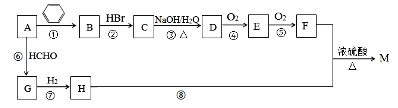
回答下列问题:
(1)A的系统命名为_________。
(2)反应⑥反应类型是____________;F中官能团的名称_______________。
(3)物质M的结构简式为_____________________。
(4)反应③的化学反应方程式为_______________________。
(5)符合下列条件的F的同分异构体共有____种。
①能发生银镜反应;②能发生水解反应;③属于芳香族化合物;④苯环上有两个氢原子被取代。(6)已知:①当苯环上已有—个“一 CH3”时,新引入的取代基一般在原有取代基的邻位或对位上。②酸性高锰酸钾溶液可以把苯环上的“一CH3”氧化成“—COOH”。请用合成反应流程图表示出由甲苯和其他物质合成![]() 的最佳方案,合成反应流程表示方法示例如下:
的最佳方案,合成反应流程表示方法示例如下: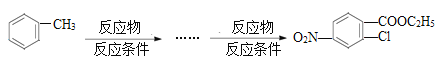 ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列有关说法正确的是( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为2NA
C.71gCl2所含原子数为2NA
D.23g钠在化学反应中失去电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其氯的化合物,有广泛的应用。请回答下列问题:
(1)亚氯酸(HClO2)中氯元素的化合价是____,其电离方程式是______________,NaClO2溶液显_________(填“酸性”、“中性”、“碱性”)。
(2)①向新制饱和氯水中加适量CaCO3制取次氯酸,其反应的总的离子方程式是:_______。
②可用Cl2除去工业废水中CN- ,生成无污染的CO2和N2,写出反应的离子方程式:_____。
(3)CsICl2受热发生非氧化还原反应,则其受热分解的化学方程式是: ______________。
(4)ClO2是一种黄色极易爆炸的强氧化性气体,较安全的制备方法是:NaClO3+SO2+H2SO4—NaHSO4+ClO2(未配平),氧化剂与还原剂的物质的量之比是 _______。
(5)工业上高氯酸可由高氯酸钠和浓硫酸经复分解反应制备:NaClO4+H2SO4(浓)→NaHSO+HClO(易爆)。也可以用铜做阴极、铂做阳极,电解盐酸制备HClO4,写出阳极的电极反应式 ___________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
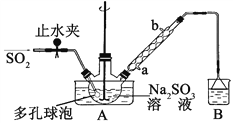
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从_____(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是__________________________________________。
(3)冷凝管中回流的主要物质除H2O 外还有________ (填化学式)。
(4)写出步骤2中发生反应的化学方程式________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是____________________________。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。 设起始
CO(g)+3H2(g)。 设起始![]() ,在恒压下,平衡时CH4的体积分数
,在恒压下,平衡时CH4的体积分数![]() 与Z和T(温度)的关系如图所示,下列说法错误的是
与Z和T(温度)的关系如图所示,下列说法错误的是
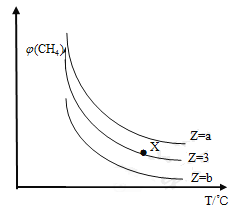
A. 该反应的焓变△H>0
B. 图中Z的大小为b>3>a
C. 图中X点对应的平衡混合物中![]()
D. 温度不变时,加压,平衡逆向移动,甲烷的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求完成填空:
(1)下列物质中,电解质;非电解质A.氢氧化钠溶液 B.液氨 C.氯化钠晶体 D.二氧化碳 E.硫酸钡
(2)100mLFe2(SO4)3溶液中含有Fe3+11.2g,其中铁离子的物质的量n(Fe3+)= , 硫酸根离子的物质的量浓度c(SO ![]() )= , 取25mL溶液稀释到100mL,则稀释后溶液中Fe3+的物质的量浓度是c(Fe3+)= , 稀释后溶液中Fe2(SO4)3的质量m= .
)= , 取25mL溶液稀释到100mL,则稀释后溶液中Fe3+的物质的量浓度是c(Fe3+)= , 稀释后溶液中Fe2(SO4)3的质量m= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是:
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法错误的是
A.SO2可用作食品添加剂B.CCl4 可用于鉴别溴水和碘水
C.浓氨水可用来清洗试管壁的银镜D.Na2S 可除去污水中的 Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com