
【题目】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
(1)上述反应的熵变ΔS__0(填“>”“<”或“=”,下同),该反应能够自发进行,则反应的ΔH__0。
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是__(填字母代号,下同)
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)一定温度下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2和CO2的物质的量之比保持不变
D.每生成1molN2的同时生成2molNO
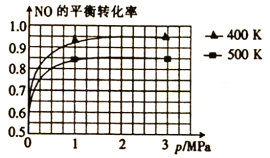
(4)已知上述反应中NO的平衡转化率与压强、温度的关系如图所示。工业上催化装置比较适合的温度和压强是__。
A.400K;3MPa B.400K;1.5MPa C.400K;1MPa D.500K;1MPa
【答案】< < CD AD C
【解析】
(1)反应后气体分子数减小,由此可得出上述反应的熵变ΔS<0。利用G=H-TS<0,可确定该反应能够自发进行时,则反应的ΔH<0;
(2)A.选用更有效的催化剂,加快反应速率,但不影响反应物的转化率,A不合题意;
B.升高反应体系的温度,平衡逆向移动,NO的转化率减小,B不合题意;
C.降低反应体系的温度,平衡正向移动,NO的转化率增大,C符合题意;
D.缩小容器的体积,相当于加压,平衡正向移动,NO的转化率增大,D符合题意;
故选CD;
(3)A.反应达平衡前,压强不断减小,所以压强不变时,反应达平衡状态,A符合题意;
B.混合气体始终都呈无色,所以气体颜色不变时,不一定达平衡状态,B不合题意;
C.根据方程式,生成的N2和CO2的物质的量之比始终为1:2,则反应不一定达平衡状态,C不合题意;
D.每生成1molN2的同时生成2molNO,反应方向相反,且变化量之比等于化学计量数之比,则反应达平衡状态,D符合题意;
故选AD;
(4)从图中可以看出,400K时NO的平衡转化率大,且温度低;1.5MPa时,NO的平衡转化率接近最大值,但是压强1.5MPa时的转化率,并没有比压强为1MPa时的转化率大很多,但是压强增大,会增加经济成本,因此压强1MPa更加符合工业生成,故选C。


科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
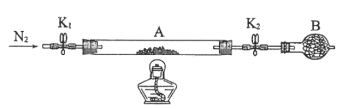
①仪器B的名称是________。
②将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2 c.关闭K1和K2
d.熄灭酒精灯 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。若实验时按a、b次序操作,则使x_______(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
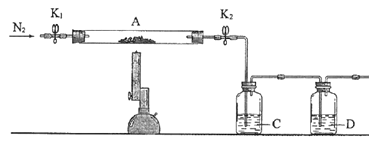
①C中的溶液为BaCl2,其作用是______。D溶液为______,D中可观察到的现象为_______。
②写出硫酸亚铁高温分解反应的化学方程式________。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
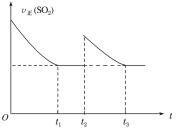
A.t2时改变的条件是:只加入一定量的SO2
B.t1时平衡常数K1大于t3时平衡常数K2
C.t1时平衡混合气体的平均相对分子质量大于t3时平衡混合气体的平均相对分子质量
D.t1时平衡混合气体中SO3的体积分数等于t3时平衡混合气体中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学--选修3 物质结构与性质)
二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
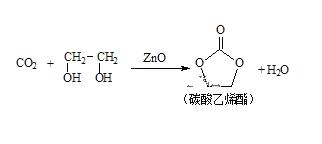
回答下列问题:
(1)锌基态离子的价电子排布式为_______________。
(2)乙二醇中C、H、O的电负性大小关系是__________;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol碳酸乙烯酯中含有的σ键的数目为_______NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,[Zn(H2O)6]2+中所含化学键的类型为____。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溴乙烷的说法正确的是( )
A.溴乙烷的电子式![]()
B.用溴乙烷制取乙二醇经过以下几步:消去![]() 加成
加成![]() 水解
水解
C.溴乙烷与KOH醇溶液反应:CH3CH2Br+H2O![]() C2H5OH+KBr
C2H5OH+KBr
D.向溴乙烷中滴入![]() 溶液检验其中的溴元素:
溶液检验其中的溴元素:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
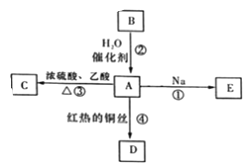
(1)A的官能团名称是____________,B的结构简式____________。
(2)反应②的反应类型为________________________________。
(3)发生反应①时钠在__________________________(填“液面上方”或“液体底部”)。
(4)写出反应③的化学方程式_______________________。
(5)写出反应④的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、![]() 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
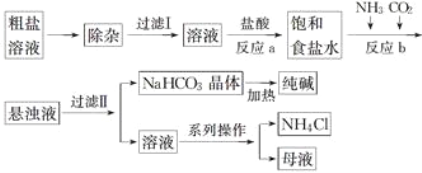
A. 在“侯氏制碱法”中涉及到了氧化还原反应
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PTT是一种高分子材料,能作为纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
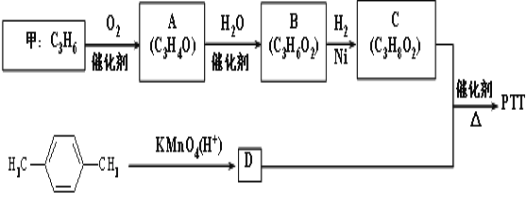
其中A、B、C均为链状化合物,A能发生银镜反应,C不含甲基,1molC可与足量钠反应生成22.4LH2(标准状况)。请回答下列问题:
(1)A的结构简式为___,C的名称___(系统命名)。
(2)1molD与足量的烧碱溶液反应最多消耗NaOH___mol。
(3)指出反应类型A→B___;C和D生成PTT___。
(4)由物质B生成C的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com