
| A、1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
| B、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
| C、标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA |
| D、6.8g液态KHSO4中含有0.1NA个阳离子 |


科目:高中化学 来源: 题型:

| A、装置①可用于验证Na与H2O反应是否放热 |
| B、装置②可用于比较Na2CO3与NaHCO3的稳定性 |
| C、装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D、装置④可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、若完全燃烧,1mol雄酮(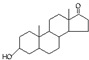 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、已知中和热为△H=-57.4 kJ?mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 |
| D、已知S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-不能大量共存(常温下) | ||
B、
| ||
| C、已知:25℃时,Mg(OH)2的kSP=5.61×10-12,MgF2的kSP=7.42×10-11、25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2可以转化为MgF2 | ||
| D、在6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑反应中,XeF4按已知方式水解,每生成4mol Xe,转移16mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol/L HF溶液中pH=1 |
| B、0.2mol/L MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-) |
| C、2HF(aq)+Mg2+(aq)?MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107 |
| D、该反应体系中有MgF2沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com