
| c(H+).c(CH3COO-) |
| c(CH3COOH) |
| c(H+).c(CH3COO-) |
| c(CH3COOH) |
| 10-7.(0.5a-0.01) |
| 0.01 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 历史上最早应用的还原性染料是靛蓝.春秋时期,我国先民已能从蓝草中提出这种染料,早于欧洲1500多年.其结构简式如图所示,下列关于靛蓝的叙述,错误的是( )
历史上最早应用的还原性染料是靛蓝.春秋时期,我国先民已能从蓝草中提出这种染料,早于欧洲1500多年.其结构简式如图所示,下列关于靛蓝的叙述,错误的是( )| A、靛蓝由碳、氢、氧、氮4种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、该物质是高分子化合物 |
| D、它是不饱和的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸体积 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的
某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的查看答案和解析>>
科目:高中化学 来源: 题型:

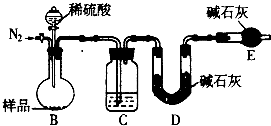
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| C、大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Cl2+2KBr═Br2+2KCl |
| B、2NaHCO3?Na2CO3+H2O+CO2 |
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| D、2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,该溶液的pH=7 |
| B、适当加热该溶液,溶液的PH值升高 |
| C、c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、c(Na+)+c(H+)=c(A-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com