
| A、向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | ||||
B、NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-
| ||||
| C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | ||||
| D、向KIO3与KI混合溶液中加入醋酸发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
| ||


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、通过电解熔融的Z、Q形成的化合物可制取Z单质 |
| B、原子半径的大小顺序为W>Q>Z>X>Y |
| C、元素Y的最高正化合价为+6 |
| D、XQ3分子中,中心原子是sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
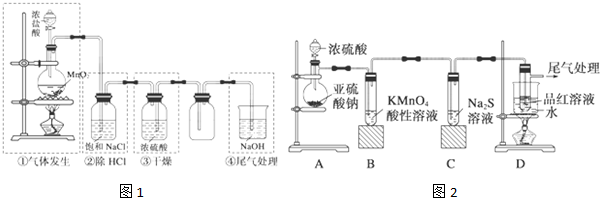
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用渗析的方法精制Fe(OH)3胶体 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热蒸发结晶的方法从AlCl3溶液得到AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| B、保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | ||
C、反应在t1min内的平均速率为v(H2)=
| ||
| D、温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ca2+、Cl-、CO32- |
| B、NO3-、Cl-、K+、H+ |
| C、Na+、Fe3+、SO42-、OH- |
| D、Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
x- 3 |
| A、+4 | B、+5 | C、+6 | D、+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Q2<
| ||
B、Q2=
| ||
C、Q2>
| ||
| D、Q1=Q2=197kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com