
����Ŀ����ͼ��ʾ���Իش��������� �����ݹ��ʺ��ʣ���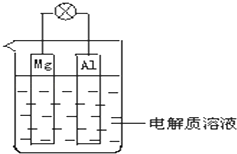
��1����װ�������ԭ��ء����ء�����
��2���������ҺΪϡH2SO4ʱ��Mg�缫Ϊ����Al�缫Ϊ����������������������缫�������������Һ��SO ![]() ��������ҡ����ƶ���Mg�缫�Ϸ����ķ�ӦΪ��Al�缫�Ϸ����ķ�ӦΪ��
��������ҡ����ƶ���Mg�缫�Ϸ����ķ�ӦΪ��Al�缫�Ϸ����ķ�ӦΪ��
��3���������ҺΪNaOH��aq��ʱ����Mg�缫Ϊ����Al�缫Ϊ��������������������������缫�������������Һ���������ӷ��ţ������ƶ���Mg�缫�Ϸ����ķ�ӦΪ�� �� Al�缫�Ϸ����ķ�ӦΪ�� ��
���𰸡�
��1��ԭ���
��2����������þ����Mg��2e��=Mg2+��2H++2e��=H2��
��3�������������������ӣ�2H2O+2e��=H2��+2OH����Al��3e��+4OH��=AlO ![]() +H2O
+H2O
���������⣺��1����װ���ǻ�ѧ��ת��Ϊ���ܣ����Ը�װ����ԭ��أ����Դ��ǣ�ԭ��أ���2���������ҺΪϡH2SO4ʱ��þ����������ϡ������Һ���γ�ԭ��أ���·���е������ɣ���������þ������ʧ��������þ���ӣ��缫��ӦΪ��Mg��2e��=Mg2+��������������Һ�������������缫�ϵõ����������������缫��ӦʽΪ��2H++2e��=H2�������Դ��ǣ���������þ����Mg��2e��=Mg2+��2H++2e��=H2������3���������ҺΪNaOH��Һʱ��þ��������������������Һ���γ�ԭ��أ���·���γɵ���������������������ʧ����������������Һ������ƫ��������Һ���缫��ӦΪ��Al��3e��+4OH��=AlO ![]() +H2O��þ����������Һ��ˮ�õ����������������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� ���Դ��ǣ������������������ӣ�2H2O+2e��=H2��+2OH����Al��3e��+4OH��=AlO
+H2O��þ����������Һ��ˮ�õ����������������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� ���Դ��ǣ������������������ӣ�2H2O+2e��=H2��+2OH����Al��3e��+4OH��=AlO ![]() +H2O��
+H2O��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺ 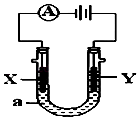
��1����X��Y���Ƕ��Ե缫��a��NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
��Y�缫�ϵĵ缫��ӦʽΪ �� ��X�������۲쵽�������ǣ�
����Y�缫����ķ����ǣ�
�ڵ���ܷ�Ӧ���ӷ���ʽΪ ��
��2����X��Y�Ծ�Ϊ���Ե缫��aΪCuSO 4 ��Һ������ʱ�Ļ�ѧ��Ӧ����ʽΪ
�� ͨ��һ��ʱ�����������Һ�м���16g CuO��ĩ��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH�����������ת�Ƶĵ��ӵ����ʵ���Ϊ ��
��3����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�IJ�����
��Y�缫�ĵ缫��Ӧʽ����˵�������ʷ����ĵ缫��Ӧ����д����
�ۼ�����·����0.04Ħ������ͨ��ʱ�����������ˣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����֪��������,A�����ҺpH=a��B�����ҺpH=b��
��1����AΪ���ᣬ��a��4����ôA��Һ��ˮ�������������Ũ��Ϊ________mol/ L��
��2����A�Ļ�ѧʽΪHR��B�Ļ�ѧʽΪMOH����a+b��14�����ߵ������Ϻ���Һ�����ԡ�������Һ�бض���һ�������ܷ���ˮ�⣬ ������Ϊ______________�������ӷ�������
��Ϻ����Һ�У�������Ũ�ȴ�С��ϵһ����ȷ����___________�����������
��c(MOH)>c(M+)>(R-)>c(H+)>c(OH-)
��c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
��c(R-)>c(M+)>c(H+) >c(OH-)
��c(M+)>c(R-)>c(OH-)>c(H+)
��c(M+)+ c(H+)=c(R-)+c(OH-)
�������ܵ���ʵ��ܽ�ƽ�����ڻ�ѧƽ���һ�֡�
��1����֪H2A��ˮ�д�������ƽ�⣺H2A![]() H+��HA-��HA-
H+��HA-��HA-![]() H+��A2-��������CaA�ı�����Һ�д�������ƽ�⣺CaA(s)
H+��A2-��������CaA�ı�����Һ�д�������ƽ�⣺CaA(s)![]() Ca2+(aq)��A2-(aq) ��H>0����ñ�����Һ��_______������������������������������������Һ�����ˮԡ�У���CaA��Ksp��________������������������С����������������
Ca2+(aq)��A2-(aq) ��H>0����ñ�����Һ��_______������������������������������������Һ�����ˮԡ�У���CaA��Ksp��________������������������С����������������
��2������Cr2O72-�ķ�ˮ���Խϴ�ij������ˮ�к�5.00��10-3 mol��L-1��Cr2O72-��Ϊʹ��ˮ�ܴ���ŷţ������´������ȼ���FeSO4��7H2O��Cr2O72-��Ӧ����Cr3+��Fe3+��Ȼ�����pH��ʹ֮����Cr(OH)3��Fe(OH)3����ʹ10 L�÷�ˮ�е�Cr2O72-��ȫת��ΪCr3+������������Ҫ����_________g FeSO4��7H2O����������ķ�ˮ�в�����c(Fe3+)��2��10-13 mol��L-1���������Cr3+��Ũ��Ϊ_________mol��L-1����֪��Ksp[Fe(OH)3]��4.0��10-38��Ksp[Cr(OH)3]��6.0��10-31����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵؿ�����Ҫ����������ε���ʽ���ڣ��䵥�ʺͻ������ڹ�ũҵ������������Ҫ��Ӧ�ã�
��1����֪���ؾ�ʯ��BaSO4���������տɷ���һϵ�з�Ӧ�����в��ַ�Ӧ���£�BaSO4��s��+4C��s��=BaS��s��+4CO��g����H=+571.2kJmol��1
BaS��s��=Ba��s��+S��s����H=+460kJmol��1
��֪��2C��s��+O2��g��=2CO��g����H=��221kJmol��1��Ba��s��+S��s��+2O2��g��=BaSO4��s����H= ��
��2���ۻƣ�As4S4���ʹƻƣ�As2S3������ȡ�����Ҫ����ԭ�ϣ���֪As2S3��HNO3�����·�Ӧ��As2S3+10H++10NO3��=2H3AsO4+3S+10NO2��+2H2O������Ӧ��ת�Ƶ��ӵ���ĿΪ2molʱ������H3AsO4�����ʵ���Ϊ ��
��3��������ʵ���Ũ��Na2S��NaOH�����Һ�еμ�ϡ������������������Ҫ��������֣�H2S��HS����S2�����ķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ��ͼ1��ʾ�����Եμӹ���H2S������ݳ������ٺ�������B��ʾ �� �ڵμ���������У���Һ��c��Na+���뺬�������Ũ�ȵĴ�С��ϵΪ������ĸ����
a��c��Na+��=c��H2S��+c��HS����+2c��S2����
b��2c��Na+��=c��H2S��+c��HS����+c��S2����
c��c��Na+��=3[c��H2S��+c��HS����+c��S2����]
��NaHS��Һ�ʼ��ԣ�������Һ�м���CuSO4��Һ��ǡ����ȫ��Ӧ��������Һ��ǿ���ԣ���ԭ�����������ӷ���ʽ��ʾ����
��4������л�� ![]() �����ȩ���Ȼ��������ʵ���֮��1��1��1��Ӧ���ɻ��һ��ɱ����м���X��H2O��
�����ȩ���Ȼ��������ʵ���֮��1��1��1��Ӧ���ɻ��һ��ɱ����м���X��H2O�� ![]() ��X�ĺ˴Ź���������ͼ2�����������Ϊ
��X�ĺ˴Ź���������ͼ2�����������Ϊ ![]() �ĺ˴Ź�������ͼ��д��X�Ľṹ��ʽ�� ��
�ĺ˴Ź�������ͼ��д��X�Ľṹ��ʽ�� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ����������ͼ��ʾ������˵������ȷ���ǣ� ��

A. ͼ��A��B��D���㴦KW��Ĺ�ϵ��B>A>D
B. 100��,��pH=2��ϡ��������μ�������pH=10��ϡ��ˮ����Һ��c(NH4+)/c(NH3H2O)��С����ַ�Ӧ����Һ����B��
C. �¶Ȳ��䣬��ˮ�м�������NH4Cl���壬�ɴ�A��仯��C��
D. ����Ũ��A����ʾ��Һ���ɴ�A��仯��B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20mL0.1mol/ LNH4HSO4��Һ�е���0.1mol/LNaOH ��Һ��ǡ�÷�Ӧ��ȫ������˵����ȷ���ǣ� ��
A. ������Ӧ�����У� c(H+)+ c(Na+)+ c(NH4+)=c(OH-)+ c(SO42-)
B. ������30mLNaOH ��Һʱ(pH>7) ��c(NH4+)>c(NH3��H2O)>c(OH-)>c(H+)
C. ������20mL NaOH ��Һʱ��2c(SO42-)=c(NH3��H2O)+ c(NH4+')
D. ����Һ������ʱ�� c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ��
��1������a�������� ��
��2��������ͼװ���Ʊ��������������������Բ����ƿ�ڷ�����Ӧ�����ӷ���ʽΪ ��
��װ��C�е���ҺΪ��B��Һ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�к�Cl�D�����ʵ���Ũ��������
A.50mL0.5mol/LKCl��ҺB.200mL0.3mol/LMgCl2��Һ
C.100mL0.25mol/LAlCl3��ҺD.500mL0.5mol/LHCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г����IJ��Ͽ��Խ��кܶ��ѧʵ��������������һЩ��ʵ��Ӧ�ü�ֵ��װ��������ͼ����һ���÷Ͼɲ��������Ŀ�����������ߵĵ�ص�ʾ��ͼ���õ�ع���ʱ���й�˵����ȷ����( )

A. �õ�ع���һ��ʱ���̿����̿�������������
B. ̿����̿���Ϸ����ķ�ӦΪ O2��4e��=2O2��
C. ̿��Ӧ����ߵ���ĸ�������
D. ��������ʴ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com