
【题目】以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH![]() ⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦ C. ①④⑤⑥⑦⑧ D. 全部
【答案】C
【解析】①Al(OH)3中Al上有空轨道,OH-中含孤电子对,Al(OH)3与OH-以配位键形成[Al(OH)4]-,结构为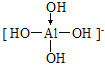 ,[Al(OH)4]-中含配位键;②CH4中C原子提供4个电子与4个H原子各提供1个电子形成4个C—H键,不含配位键;③OH-中O提供的1个电子与H提供的1个电子形成1个O—H键,不含配位键;④NH3分子中N上有孤电子对,H+有空轨道,NH3与H+以配位键形成NH4+,NH4+中含配位键;⑤Cu2+有空轨道,NH3分子中N上有孤电子对,Cu2+与NH3以配位键形成[Cu(NH3)4]2+,[Cu(NH3)4]2+中含配位键;⑥Fe3+有空轨道,SCN-含孤电子对,Fe3+与SCN-以配位键形成Fe(SCN)3,Fe(SCN)3中含配位键;⑦H2O分子中O上有孤电子对,H+有空轨道,H2O与H+以配位键形成H3O+,H3O+中含配位键;⑧Ag+有空轨道,NH3分子中N上有孤电子对,Ag+与NH3以配位键形成[Ag(NH3)2]+,[Ag(NH3)2]OH中含配位键;含配位键的为①④⑤⑥⑦⑧,答案选C。
,[Al(OH)4]-中含配位键;②CH4中C原子提供4个电子与4个H原子各提供1个电子形成4个C—H键,不含配位键;③OH-中O提供的1个电子与H提供的1个电子形成1个O—H键,不含配位键;④NH3分子中N上有孤电子对,H+有空轨道,NH3与H+以配位键形成NH4+,NH4+中含配位键;⑤Cu2+有空轨道,NH3分子中N上有孤电子对,Cu2+与NH3以配位键形成[Cu(NH3)4]2+,[Cu(NH3)4]2+中含配位键;⑥Fe3+有空轨道,SCN-含孤电子对,Fe3+与SCN-以配位键形成Fe(SCN)3,Fe(SCN)3中含配位键;⑦H2O分子中O上有孤电子对,H+有空轨道,H2O与H+以配位键形成H3O+,H3O+中含配位键;⑧Ag+有空轨道,NH3分子中N上有孤电子对,Ag+与NH3以配位键形成[Ag(NH3)2]+,[Ag(NH3)2]OH中含配位键;含配位键的为①④⑤⑥⑦⑧,答案选C。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫發療,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断不正确的是

A. ①与②、③与④分别互为同分异构体
B. ①、③互为同系物
C. 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者多
D. ①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是___,该物质中化学键类型是_____,电子式是__________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为______,化学键类型为_____(填“离子键”或“共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____________,其化学键类型为__________;加热时生成__________,其化学键类型为________,电子式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.非金属元素的原子间不能形成离子化合物
B.Cl2、Br2、I2的分子间作用力依次增强,熔沸点依次升高
C.氯化氢气体溶于水共价键被破坏
D.100℃时水由液态变为气态,分子间作用力被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
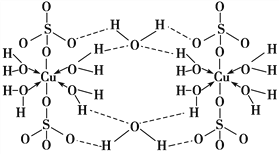
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是

A.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
B.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
C.常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA
D.2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质,并测定其结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量固体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)Y的电子式为___________。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为______________。
实验(二):探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。
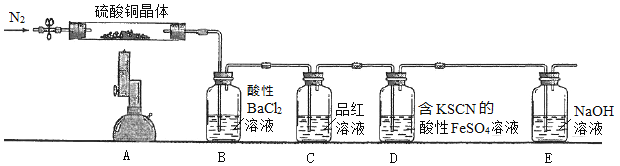
已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有________________________________。
(4)B、C装置的位置不能互换的原因是_______________________________。
(5)D中的反应分两步进行,写出第一步反应的离子方程式___________________________。
实验(三):测定硫酸铜晶体中结晶水的含量。
取wg硫酸铜晶体(CuSO4·xH2O)配成250 mL 溶液,取25.00 mL 溶液用c mol/L EDTA溶液(简写成Y4—)滴定至终点,消耗EDTA标准液V mL。
已知:滴定方程式为:Cu2++ Y4—=CuY2—。
(6)x=___________________(用代数式表示)。
(7)下列情况会使测得的x偏小的是_______(填番号)
a、样品失去部分结晶水
b、量取待测液前未用待测液润洗滴定管
c、开始读数时滴定管尖嘴有气泡而终点时无气泡
d、滴定开始时平视、滴定终点时俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com