
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
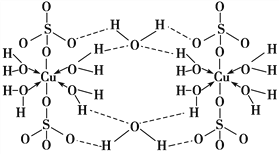
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
【答案】D
【解析】A项,胆矾中H2O中O原子形成2个σ键,O上还有两对孤电子对,H2O中O原子都采取sp3杂化,SO42-中端点氧不发生杂化,A项错误;B项,根据胆矾的结构示意图,氧原子形成极性键、配位键和氢键,氢键不属于化学键,B项错误;C项,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu2+的核外电子排布式为1s22s22p63s23p63d9,Cu2+的价电子排布式为3d9,C项错误;D项,根据胆矾的结构和胆矾可写成[Cu(H2O)4]SO4·H2O,胆矾晶体中水分子有:(1)与Cu2+形成配位键的水分子、(2)与SO42-和配体水分子形成氢键的水分子,由于作用力的不同,胆矾中的水在不同温度下会分步失去,D项正确;答案选D。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
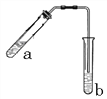
【题目】(1)乙醇与乙酸在浓硫酸作用下的反应装置如图(酒精灯等在图中均已略去)。试管b中盛有________溶液。加热一段时间后,试管b溶液上方有一层油状液体,该油状液体的名称是_________。乙醇与乙酸反应的化学方程式为__________________________________
(2)某待测液中可能含有Al3+、Fe3+、Na+、NH4+、Cl-等离子,现通过如下实验对其中的阳离子进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中逐滴滴加NaOH溶液至过量,先有白色沉淀生成,后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_____,一定没有的阳离子是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
选项 | 物质 | 性质 | 用途 |
A | Si | 硬度大 | 太阳能电池板 |
B | NH3 | 还原性 | 制冷剂 |
C | HC1O | 强氧化性 | 漂白剂 |
D | Na2O2 | 淡黄色固体 | 供氧剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH![]() ⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦ C. ①④⑤⑥⑦⑧ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. 一个苯分子含3个π键和6个σ键
B. 金属的导电性、导热性、延展性都与自由电子有关
C. C2H2分子中σ键与π键的数目比为1∶1
D. 水加热到很高温度都难分解是因水分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号 | 元素性质或原子结构 |
X | X原子的最外层电子数是其内层电子总数的2倍 |
Y | Y的基态原子价电子排布式为nsnnpn+2 |
Z | 最外层中只有两对成对电子 |
W | 前四周期基态原子中,W元素的未成对电子数最多 |
(1)元素X最高价氧化物分子的空间构型是__________________,是_________(填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种有机盐 X(仅含四种元素)的组成与性质,设计并完成如下实验:
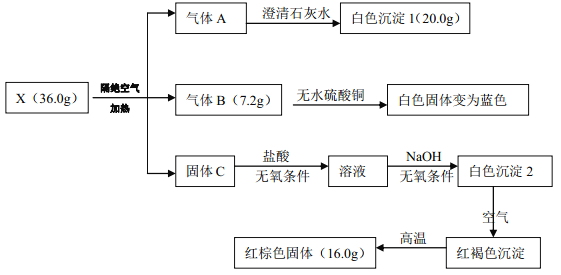
已知: A、 B、 C 均为常见物质
(1)有机盐 X 的化学式:_______。
(2)写出 X 受热分解的化学方程式:_______。
(3)一定条件下,固体 C 与气体 A 中的某一成分可能发生某一氧化还原反应生成红棕色固体, 写出此可能的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国钒电池研究获得重大突破,未来十年市场有望突破1000亿美元。某钒电池反应为2VCl2+BrCl2— ![]() 2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
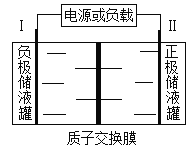
A. 放电时,I极的电极反应式为VCl2—e—+Cl—= VCl3
B. 放电时,H+由交换膜右侧向左侧迁移
C. 充电时,I极与电源负极相连,发生还原反应
D. 充电时,Ⅱ极的电极反应式为2Cl—+Br——2e—= BrCl2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO 及少量的FeO、Fe2O3) 生产氯化铜晶体的流程如下:
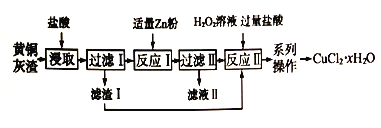
(1)反应I中所加Zn 粉不能过量的原因是_____________。
(2)滤液I中含有的主要金属阳离子是_____________。
(3) 写出反应II 的化学方程式_____________。
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、______、_____。
(5) 在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是_____________。
(6) 298K 时,向c (Cu2+) =0.02mol/L的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Cu2+是否沉淀完全? _____{列式计算,己知:Ksp[Cu(OH)2] =2.2×10-20,c(Cu2+)<1×10-5mol/L 视为沉淀完全}_____。
(7) CuCl2·xH2O晶体中x值的测定:称取3.420 g 产品溶解于适量水中,向其中加入含AgNO34.400×10-2mol 的AgNO3溶液(溶液中除Cl- 外,不含其他与Ag+反应的离子),待C1-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L 的KSCN 标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN 白色沉淀的形式析出。
①滴定终点的现象是__________。
②若滴定过程用去上述浓度的KSCN 标准溶液20.00mL,则CuCl2·xH2O中x值为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com