
【题目】某研究小组为了探究一种有机盐 X(仅含四种元素)的组成与性质,设计并完成如下实验:
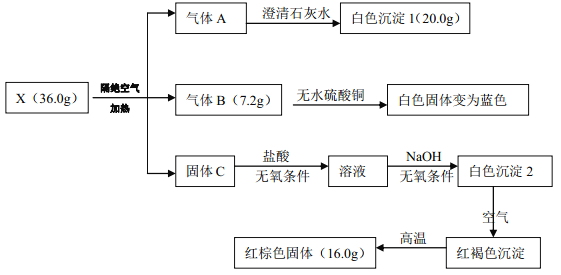
已知: A、 B、 C 均为常见物质
(1)有机盐 X 的化学式:_______。
(2)写出 X 受热分解的化学方程式:_______。
(3)一定条件下,固体 C 与气体 A 中的某一成分可能发生某一氧化还原反应生成红棕色固体, 写出此可能的化学方程式_______。
【答案】 FeC2O4·2H2O FeC2O4·2H2O = FeO+2H2O+CO+CO2 2FeO+ CO2= Fe2O3+ CO
【解析】试题分析: 由题意可知,有机盐X隔绝空气加热分解得到常见物质A、 B、 C,A能使澄清的石灰水变浑,则A中含二氧化碳气体;B能使无水硫酸铜变蓝,则C为水蒸气;C可溶于盐酸,所得溶液在无氧条件下与氢氧化钠反应可生成白色沉淀,白色沉淀在空气中变化红褐色沉淀,该沉淀高温条件下变为红棕色固体,综合这些现象可知C为氧化亚铁、红棕色固体为氧化铁。n(FeO)=2n(Fe2O3)= ![]() ,n(H2O)=
,n(H2O)= ![]() ,n(CO2)=
,n(CO2)= ![]() ,因为X仅含四种元素,所以n(CO)=
,因为X仅含四种元素,所以n(CO)= ![]() 。n(Fe):n(C):n(O):n(H)=0.2:0.4:1.2:0.8=1:2:6:4,所以X的化学式为FeC2O6H4 或FeC2O4·2H2O(二水合草酸亚铁)。
。n(Fe):n(C):n(O):n(H)=0.2:0.4:1.2:0.8=1:2:6:4,所以X的化学式为FeC2O6H4 或FeC2O4·2H2O(二水合草酸亚铁)。
(1)矿物盐 X 的化学式:FeC2O4·2H2O。
(2)写出 X 受热分解的化学方程式:FeC2O4·2H2O = FeO+2H2O+CO↑+CO2↑。
(3)一定条件下,固体 FeO 与气体 A 中的某一成分可能发生某一氧化还原反应生成红棕色固体,可能是CO2与其反应,化学方程式为2FeO+ CO2= Fe2O3+ CO。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.非金属元素的原子间不能形成离子化合物
B.Cl2、Br2、I2的分子间作用力依次增强,熔沸点依次升高
C.氯化氢气体溶于水共价键被破坏
D.100℃时水由液态变为气态,分子间作用力被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
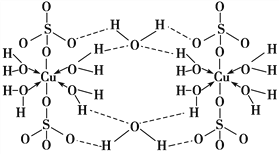
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是

A.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
B.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
C.常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA
D.2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI
+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是_________;氧化产物与还原产物的物质的量比是__________;如果反应生成0.3mol的单质碘,则转移的电子数目是_______。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是___________________________;
(3)若采用下图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①_____;该装置还缺少的仪器是_____;冷凝管的进水口是:_____(填g或f)
(4)在容量瓶的使用方法中,下列操作正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(5)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的硫酸溶液500mL,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______ mL,如果实验室有15mL、20mL、50mL量筒,应选用________ mL量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是_____________。
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com