
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
【答案】D
【解析】根据Ka=c(H+)×c(F-)/c(HF), Ka/c(F-)=![]() ,随着溶液pH增大,酸性减弱,碱性增强,溶液中c(F-)逐渐增大,Ka/c(F-)逐渐减小,
,随着溶液pH增大,酸性减弱,碱性增强,溶液中c(F-)逐渐增大,Ka/c(F-)逐渐减小,![]() 不断减小,A错误;酸溶液抑制水的电离,酸性越强对水电离抑制程度越大,水电离出的c(H+)就越小,从图像可以看出,X 、Q、Y三点对应溶液的pH逐渐增大,酸性减弱,所以由水电离出的c(H+)应逐渐增大,B错误;HF的电离常数Ka=c(H+)×c(F-)/c(HF),当c(F-)= c(HF)时,溶液的pH=10-3.4mol/L,所以HF的电离常数Ka=1.0×10-3.4,C错误;0.1 mol/LNaF溶液水解平衡常数Kh=KW/Ka=1×10-14/1.0×10-3.4=10-10.6, Kh= c(HF)×c(OH-)/c(F-)= c2(OH-)/0.1=10-10.6, c(OH-)=10-5.8mol/L, c(H+)=10-8.2 mol/L, pH约为8.2,D正确;正确选项D。
不断减小,A错误;酸溶液抑制水的电离,酸性越强对水电离抑制程度越大,水电离出的c(H+)就越小,从图像可以看出,X 、Q、Y三点对应溶液的pH逐渐增大,酸性减弱,所以由水电离出的c(H+)应逐渐增大,B错误;HF的电离常数Ka=c(H+)×c(F-)/c(HF),当c(F-)= c(HF)时,溶液的pH=10-3.4mol/L,所以HF的电离常数Ka=1.0×10-3.4,C错误;0.1 mol/LNaF溶液水解平衡常数Kh=KW/Ka=1×10-14/1.0×10-3.4=10-10.6, Kh= c(HF)×c(OH-)/c(F-)= c2(OH-)/0.1=10-10.6, c(OH-)=10-5.8mol/L, c(H+)=10-8.2 mol/L, pH约为8.2,D正确;正确选项D。


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某实验兴趣小组按如图装置实验后,所记录内容合理的是
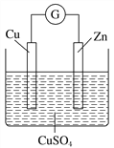
实验记录 | ①Zn片为负极,质量减少,Cu为正极,质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42向Zn极移动,Cu2+向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e===Cu; ⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极 |
A. ①②④B. ②③④C. ②③④⑤D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. 一个苯分子含3个π键和6个σ键
B. 金属的导电性、导热性、延展性都与自由电子有关
C. C2H2分子中σ键与π键的数目比为1∶1
D. 水加热到很高温度都难分解是因水分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种有机盐 X(仅含四种元素)的组成与性质,设计并完成如下实验:
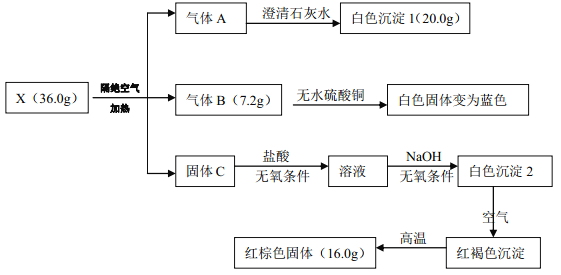
已知: A、 B、 C 均为常见物质
(1)有机盐 X 的化学式:_______。
(2)写出 X 受热分解的化学方程式:_______。
(3)一定条件下,固体 C 与气体 A 中的某一成分可能发生某一氧化还原反应生成红棕色固体, 写出此可能的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: A 用于医疗消毒, C 为常用调味品; E 与 B 都能发生银镜反应, E 的相对分子质量比 B 大 12,请回答:
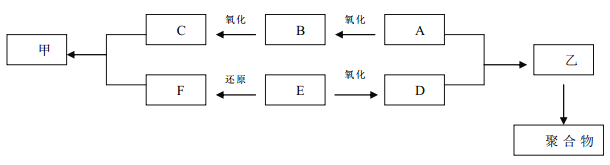
(1)求 E 的结构简式_______;乙生成聚合物的反应类型_______。
(2)C 生成甲的方程式_______。
(3)下列说法不正确的是________。
A. 物质 A 与金属钠反应比水与金属钠反应要剧烈
B. 用蒸馏的方法分离物质 A 与 C 可得到纯净的 A
C. 根据溴水褪色现象,可以证明物质 E 中一定存在碳碳双键
D.新制碱性氢氧化铜悬浊液可鉴别物质 A、 B 和 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国钒电池研究获得重大突破,未来十年市场有望突破1000亿美元。某钒电池反应为2VCl2+BrCl2— ![]() 2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
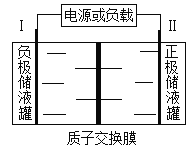
A. 放电时,I极的电极反应式为VCl2—e—+Cl—= VCl3
B. 放电时,H+由交换膜右侧向左侧迁移
C. 充电时,I极与电源负极相连,发生还原反应
D. 充电时,Ⅱ极的电极反应式为2Cl—+Br——2e—= BrCl2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 气体摩尔体积是指1 mol任何气体占有的体积都约是22.4 L
B. 1 L一氧化碳气体一定比1 L氧气的质量小
C. 在常温、常压下,11.2 L N2含有的分子数是0.5NA
D. 32 g O2在标准状况下的体积约是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对离子方程式的评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | H2SO4溶液与Ba(OH)2溶液反应: H++ SO42-+Ba2++OH | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸: CO32-+2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | 向NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:

(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。

(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com