
【题目】某实验兴趣小组按如图装置实验后,所记录内容合理的是
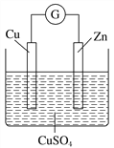
实验记录 | ①Zn片为负极,质量减少,Cu为正极,质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42向Zn极移动,Cu2+向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e===Cu; ⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极 |
A. ①②④B. ②③④C. ②③④⑤D. ②③④⑤⑥
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,是一种常见的有机溶剂。s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是( )
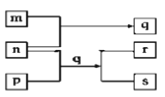
A. q的水溶液呈黄色 B. W的氧化物常温常压下为液态
C. p能使酸性高锰酸钾溶液褪色 D. Z的氧化物的水化物可能为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
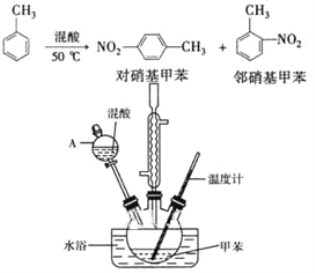
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_______________________。反应中需不断搅拌,目的是__________________________________________。
(2)仪器A的名称是______,使用该仪器前必须进行的操作是____。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_____。
(4)分离反应后产物的方案如下:

其中,操作1的名称为______,操作2中需要使用下列仪器中的____(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(5)该实验中一硝基甲苯的产率为______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s后容器中N2的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 3.6 mol D. 3.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是___,该物质中化学键类型是_____,电子式是__________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为______,化学键类型为_____(填“离子键”或“共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____________,其化学键类型为__________;加热时生成__________,其化学键类型为________,电子式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)有下列六组物质:属于同系物的是______,属于同分异构体是______,属于同种物质的是______(填序号)。
A.![]() 与
与![]() B.
B.![]() 与
与![]() C.
C.![]() 与
与![]()
D.![]() 与
与![]() E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.![]() 与CH3﹣CH2Cl
与CH3﹣CH2Cl
(2)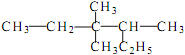 的系统命名_________________。
的系统命名_________________。
(3)![]() 的系统命名__________________________。
的系统命名__________________________。
(4)右图有机物的分子式_________________![]() 。
。
(5)甲基的电子式_________________。
(6)某烃的分子量为72,跟氯气反应生成的一氯代物只有一种,该烃的结构简式为_________________。
(7)C7H8O属于芳香族化合物且能发生催化氧化反应,该反应方程式为:_________________。
(8)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.非金属元素的原子间不能形成离子化合物
B.Cl2、Br2、I2的分子间作用力依次增强,熔沸点依次升高
C.氯化氢气体溶于水共价键被破坏
D.100℃时水由液态变为气态,分子间作用力被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com