
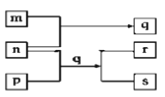
【题目】元素W、X、Y、Z原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,是一种常见的有机溶剂。s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是( )
A. q的水溶液呈黄色 B. W的氧化物常温常压下为液态
C. p能使酸性高锰酸钾溶液褪色 D. Z的氧化物的水化物可能为强酸
【答案】C
【解析】元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物,m、n分别是元素Y、Z的单质,n通常为深红棕色液体,n为Br2,0.01 mol/L的r溶液pH为2,r为强酸,则r为HBr,p被英国科学家法拉第称为“氢的重碳化合物”,p为苯,s通常是难溶于水、比水重的油状液体,s为溴苯,q为FeBr3,m为Fe,综上所述,W、X、Y、Z分别为H、C、Fe、Br元素,p、q、r分别为C6H6、FeBr3、HBr,m、n分别为Fe和Br2。A. q为FeBr3,含有Fe3+的溶液呈黄色,故A正确;B. W为H元素,氧化物可能是H2O或H2O2,H2O或H2O2在常温常压下均为液体,故B正确;C. p为苯,和酸性高锰酸钾溶液不反应,不能使酸性高锰酸钾溶液褪色,故C错误;D. Z为Br元素,溴元素的最高价氧化物对应水化物HBrO4是强酸,故D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
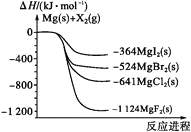
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol甲烷和氯气发生取代反应,待反应完成后,测得四种取代物的物质的量相等,则消耗氯气的物质的量为
A.0.5molB.2molC.2.5molD.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某碱性硼化钒(VB2)-空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
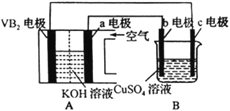
A. VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
C. 外电路中电子由a电极流向b电极
D. 若B装置内的液体体积为400mL,则CuSO4溶液物质的量浓度为0.025mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
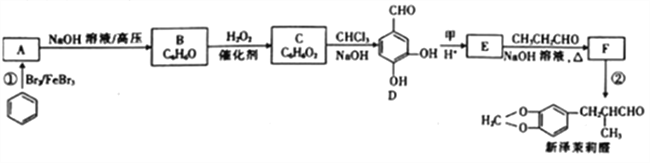
已知:①RCHO+R'CH2CHO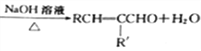
②
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备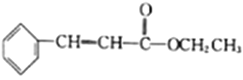 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是: 2Cu2O+Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为________;Cu2O与Cu2S比较,熔点较高的是_____,原因是________。.
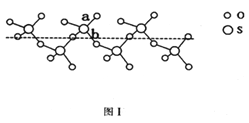
(2)SO2与SO3的健角相比,键角更大的是_____,将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1,此固态SO3中S原子的杂化轨道类型是_________;该结构中S-O键长有两类。一类键长约140pm,另一类键长月为160pm,较短的键为_______。(填图中字母)
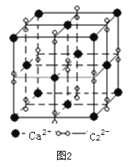
(3)离子化合物CaC2的一种晶体结构如图2所示。该物质的电子式_____。从钙离子看,属于________堆积,其配位数是_________;一个晶胞含有的π键平均有________个。
(4)奥氏体是碳溶解γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为________pm (阿伏加德罗常数的值用NA表示,写出计算式即可)。
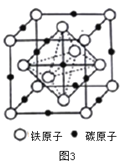
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组按如图装置实验后,所记录内容合理的是
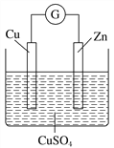
实验记录 | ①Zn片为负极,质量减少,Cu为正极,质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42向Zn极移动,Cu2+向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e===Cu; ⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极 |
A. ①②④B. ②③④C. ②③④⑤D. ②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com