
����Ŀ����֪ij������(VB2)-������ع���ʱ������ӦΪ��11O2+4VB2=2V2O5+4B2O3���Ըõ����Ϊ��Դ��ʹ�ö��Ե缫�������ͭ��Һ��ʵ��װ����ͼ��ʾ�������·��ͨ��0.04mol����ʱ��Bװ���ڹ��ռ���0.448L����(��״��)��������˵����ȷ���ǣ� ��
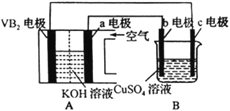
A. VB2�缫�����ĵ缫��ӦΪ��2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. �������У�b�缫�������к�ɫ����������Ȼ�������ݲ���
C. ���·�е�����a�缫����b�缫
D. ��Bװ���ڵ�Һ�����Ϊ400mL����CuSO4��Һ���ʵ���Ũ��Ϊ0.025mol/L
���𰸡�D
���������ڼ�����-��������У�VB2�ڸ���ʧ���ӣ������������õ��ӣ�����ܷ�ӦΪ��11O2+4VB2=2V2O5+4B2O3�����븺��������cΪ���ص���������Һ�е�ͭ������c���ϵõ��ӷ�����ԭ��Ӧ��������������bΪ���ص�������������������b����ʧ���ӷ���������Ӧ��A. ��������VB2ʧ���ӷ���������Ӧ��VB2�缫�����ĵ缫��ӦΪ��2VB2+22OH22e=V2O5+2B2O3+11H2O����A����B. �������У���a�缫������bΪ���ص���������b�缫�ϣ�����������ʧ����������������ɫ��Cu������������B����D. �����·����������VB2�缫����c�缫����C����D. Bװ����������������bΪ����������������ʧ���������������缫��ӦʽΪ��4OH4e= O2��+11H2O���ɵ缫��Ӧʽ��֪�������·��ͨ��0.04mol����ʱ���������������ʵ���Ϊ0.01mol��Bװ���й��ռ���0.448L����(��״��)�����������ʵ���Ϊ��0.448L��22.4L/mol=0.02mol������������0.01moL��������c�缫Ϊ�������缫��ӦʽΪ��Cu2��+2e=Cu��2H��+2e=H2�������ݵ�ʧ�����غ㣬��Һ��ͭ���ӵ����ʵ���Ϊ��(0.04mol0.01mol��2)��2=0.01mol����CuSO4��Һ�����ʵ���Ũ��Ϊ0.01mol��0.4L=0.025mol/L����D��ȷ����ѡD��


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�������У���ͨ��������������ɱ��������������ˮ��Ӧ�IJ���֮һ�����ᡣ�г�����Щ�����̷�ΪIJȡ��������������ˮð�䴿��ˮͰװ���ۡ�Ϊ�����α������������һ���Լ������� ��
A.��̪��ҺB.�Ȼ�����ҺC.����������ҺD.��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ϩ��A(C8H16)���Է�����ͼ��ʾ��ת�����ص���������:
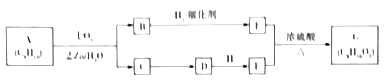
��֪:a. 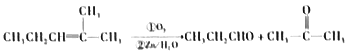
b.B�ĺ˴Ź�������ͼ����2���壬�����֮����2:3.
(1)B�ķ���ʽΪ______;E������Ϊ______��1molE������_____molNa2CO3��Ӧ.
(2)�C![]() D��E+F
D��E+F![]() G��Ӧ�Ļ�ѧ����ʽ:___________��
G��Ӧ�Ļ�ѧ����ʽ:___________��
(3)A���γɸ߷���(C8H16)n��ƽ��1molA�к��еļ�����____(��NA��ʾ�����ӵ�������ֵ)��
(4)B���ܷ���������Ӧ����ͬ���칹��X�ܷ���������Ӧ��X�Ľṹ��____�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��M��N ��ԭ����������������ԭ������������֮��Ϊ23��X ��ԭ�Ӱ뾶��Y ��С��X ��W ͬ���壬Z �������������ǵ��Ӳ�����3����M �ǵؿ��к�����ߵĽ���Ԫ�ء�
��1��M�����ӽṹʾ��ͼ____________��X��Y�γɵĺ�18���ӵĻ�����ĵ���ʽ____________��
�õ���ʽ��ʾ��W��Z�γɵ�ֻ�����Ӽ��Ļ�������γɹ���______________________��
��2��Y��Z��Mԭ�Ӱ뾶�ɴ�С��˳��____________����Ԫ�ط��ű�ʾ����Z���⻯���ȶ���_____N���⻯���ȶ��ԣ��������� �������� ��=����
��3��X��Z��ɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ�����_________���ѧʽ�����˻�����ɽ����Թ�ҵ��ˮ�е�CN-����Ϊ̼���κͰ�������Ӧ�����ӷ���ʽΪ��___________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����[��Ҫ�ɷ�ΪFe(CrO2)2��������Al2O3��Fe2O3��SiO2������]Ϊ��Ҫԭ�������ظ����ƾ���(Na2Cr2O7��2H2O��Na2Cr2O7��һ��ǿ������)����Ҫ��������������
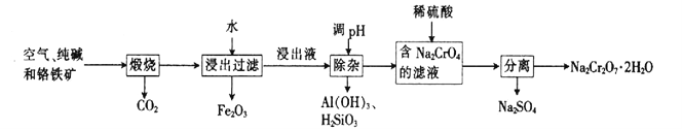
��1���Ǹ�������[Fe(CrO2)2]��Cr�Ļ��ϼ���___________��
��2����������Na2CrO4�Ļ�ѧ����ʽΪ___________��
��3���ữ��ҺNa2CrO4ʱ����ѡ�ø����ԭ����____________________����ƽ��Ƕȷ����ữ��ԭ����______________________��
��4���ù�����ij�ֲ�������������������ʵĻ�ѧʽΪ________________��
��5������ʯī�缫���Na2CrO4��Һ����ʵ��Na2CrO4��Na2Cr2O7��ת������ԭ����ͼ��ʾ��,
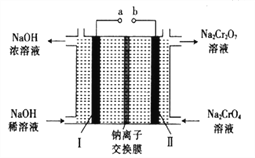
��д�����缫�ĵ缫��Ӧʽ_______________________��
����Na2CrO4ת��Ϊ1malNa2Cr2O7ʱ�����������缫��ת�Ƶ��ӵ����ʵ���Ϊ________��
��3����ȡ2.500g�ظ����ƾ�����������������ˮ���Ƴ�250ml��Һ������ȡ��25.00mL�ڵ���ƿ���������м���10mL2mol��L-1 H2SO4��Һ�������⻯��(���Ļ�ԭ����ΪCr3+)�����ڰ���5min��Ȼ�����100mLˮ������3mL����ָʾ������0.120mol��L-1��Na2S2O3����Һ���еζ�(������Ӧ��I2+2S2O32-=2I-+S4O62-)��
���жϴﵽ�ζ��յ��������______________________��
����ʵ���й���ȥ40.00mL��Na2S2O3����Һ�������ò�Ʒ�Ĵ���Ϊ_____________(�������������������ʲ����練Ӧ)(����3λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֧�ֹ�̬���Ƿ��Ӿ������ʵΪ�� ��
A. ��ԭ�Ӳ����γ������� B. ����Ӳ��ܵ�������
C. �����°�����̬���� D. ����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��W��X��Y��Zԭ�������������ӡ�p��q��r������ЩԪ����ɵĶ�Ԫ�����m��n�ֱ���Ԫ��Y��Z�ĵ��ʣ�nͨ��Ϊ�����ɫҺ�壬0.01 mol/Lr��Һ��pHΪ2��p��Ӣ����ѧ�ҷ����ڳ�Ϊ�������̼���������һ�ֳ������л��ܼ���sͨ����������ˮ����ˮ�ص���״Һ�塣�������ʵ�ת����ϵ��ͼ��ʾ������˵��������ǣ� ��
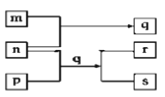
A. q��ˮ��Һ�ʻ�ɫ B. W�������ﳣ�³�ѹ��ΪҺ̬
C. p��ʹ���Ը��������Һ��ɫ D. Z���������ˮ�������Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijͬѧ��Ƶķ��ȷ�Ӧ�Ĺ۲�װ������ʵ���������������
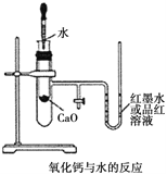
�� ��ͼ��ʾ��ʵ��װ�����Ӻã�
�� �� U �ι��ڼ���������īˮ(��Ʒ����Һ)���� T �ιܻ�����ʹ U �ι������ߵ�Һ�洦��ͬһˮƽ �棬�ٹر� T �ιܻ�����
�� ��ʢ�� 1.0g �����Ƶ�С�Թ������ 2mL ���ҵ�����ˮ���۲����� �Իش�
��1��ʵ��ǰ������е�һ��ʵ�������_____��
��2��ʵ���й۲쵽��������_____��
��3��˵��CaO��H2O��������Ca(OH)2������֮��Ĺ�ϵ��_________��
��4������ʵ���� CaO ���� NaCl��ʵ�黹�ܷ�۲쵽��ͬ����?_____(�������� ��������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ������������ʪ�Ƚϴ��νϸ߶����γɴ��������������з�ɢϵ�е�
A.����B.��ҺC.����ҺD.����Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com