
����Ŀ������������Ԫ��X��Y��Z��W��M��N ��ԭ����������������ԭ������������֮��Ϊ23��X ��ԭ�Ӱ뾶��Y ��С��X ��W ͬ���壬Z �������������ǵ��Ӳ�����3����M �ǵؿ��к�����ߵĽ���Ԫ�ء�
��1��M�����ӽṹʾ��ͼ____________��X��Y�γɵĺ�18���ӵĻ�����ĵ���ʽ____________��
�õ���ʽ��ʾ��W��Z�γɵ�ֻ�����Ӽ��Ļ�������γɹ���______________________��
��2��Y��Z��Mԭ�Ӱ뾶�ɴ�С��˳��____________����Ԫ�ط��ű�ʾ����Z���⻯���ȶ���_____N���⻯���ȶ��ԣ��������� �������� ��=����
��3��X��Z��ɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ�����_________���ѧʽ�����˻�����ɽ����Թ�ҵ��ˮ�е�CN-����Ϊ̼���κͰ�������Ӧ�����ӷ���ʽΪ��___________________________________________________________��
���𰸡�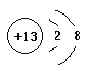
![]()
![]() Al��N��O �� H2O2 H2O2+CN-+OH-=CO32-+NH3��
Al��N��O �� H2O2 H2O2+CN-+OH-=CO32-+NH3��
��������
����������Ԫ��X��Y��Z��W��M��N ��ԭ��������������Z�������������ǵ��Ӳ�����3����˵��Z��OԪ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�أ���M��AlԪ�أ�X��ԭ�Ӱ뾶��Y��С��X��Wͬ���壬����ԭ��������������Ĺ�ϵ�������ж�XΪHԪ����WΪNaԪ�أ�H��O��Na��Al����Ԫ������������֮��Ϊ11����Y��NԪ������������֮��Ϊ23��11=12��Y������������Ϊ5��YΪNԪ�أ�N������������Ϊ7��N��ClԪ�ء�
(1). M��AlԪ�أ�Alԭ��ʧȥ3�����ӱ��Al3+��Al3+�����ӽṹʾ��ͼΪ��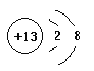 ��H��NԪ���γɵĺ�18���ӵĻ�����ΪN2H4��N2H4�ǹ��ۻ���������ʽΪ��
��H��NԪ���γɵĺ�18���ӵĻ�����ΪN2H4��N2H4�ǹ��ۻ���������ʽΪ��![]() ��Na��OԪ���γɵ�ֻ�����Ӽ��Ļ�������Na2O��Oԭ�ӵõ�2��Naԭ��ʧȥ��2�������γ�Na2O���õ���ʽ��ʾNa2O���γɹ���Ϊ��
��Na��OԪ���γɵ�ֻ�����Ӽ��Ļ�������Na2O��Oԭ�ӵõ�2��Naԭ��ʧȥ��2�������γ�Na2O���õ���ʽ��ʾNa2O���γɹ���Ϊ��![]() ��
��
�ʴ�Ϊ��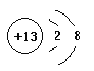 ��
��![]() ��
��![]() ��
��
(2). ͬһ������ԭ�����������ӣ�Ԫ�ص�ԭ�Ӱ뾶��С��ͬһ������ԭ�����������ӣ�Ԫ�ص�ԭ�Ӱ뾶����������N��O��Al��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��Al��N��O���ǽ�����O��Cl�����⻯����ȶ�����H2O��HCl���ʴ�Ϊ��Al��N��O������
(3). H��OԪ���γɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ�����H2O2��H2O2�ɽ����Թ�ҵ��ˮ�е�CN������Ϊ̼���κͰ�������Ԫ�ػ��ϼ۵ı仯�����֪��H2O2�������������ݵ�ʧ�����غ��ԭ���غ㣬�÷�Ӧ�����ӷ���ʽΪ��H2O2+CN��+OH��=CO32��+NH3�����ʴ�Ϊ��H2O2��H2O2+CN��+OH��=CO32��+NH3����


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���˵��������ȷ���ǣ�������
A. ͨʽΪCnH2n+2����һ��������
B. ͨʽΪCnH2n����һ����ϩ��
C. ͨʽΪC4H6����һ����Ȳ��
D. ��Է�������Ϊ128����һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������û�а��հ뾶��С����˳�����е���
A. Cl��Na��F��K B. F��Cl��Na��K
C. Ca2����K����Cl����S2�� D. Na����K����Cl����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij100 mL���Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ�Ϊ0.4mol/L��0.1mol/L,��û��Һ�м���1.92gͭ�ۡ�����ַ�Ӧ��������Һ�е�Cu2+�����ʵ����ǣ� ��
A. 0.45mol B. 0.225mol C. 0.3mol D. 0.0225mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol�������������ȡ����Ӧ������Ӧ��ɺ������ȡ��������ʵ�����ȣ����������������ʵ���Ϊ
A.0.5molB.2molC.2.5molD.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij������(VB2)-������ع���ʱ������ӦΪ��11O2+4VB2=2V2O5+4B2O3���Ըõ����Ϊ��Դ��ʹ�ö��Ե缫�������ͭ��Һ��ʵ��װ����ͼ��ʾ�������·��ͨ��0.04mol����ʱ��Bװ���ڹ��ռ���0.448L����(��״��)��������˵����ȷ���ǣ� ��
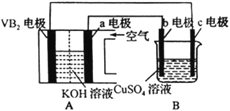
A. VB2�缫�����ĵ缫��ӦΪ��2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. �������У�b�缫�������к�ɫ����������Ȼ�������ݲ���
C. ���·�е�����a�缫����b�缫
D. ��Bװ���ڵ�Һ�����Ϊ400mL����CuSO4��Һ���ʵ���Ũ��Ϊ0.025mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڽ���Ԫ�ؼס�����Ԫ�����ڱ��е����λ�����±���ʾ�������ж���ȷ����(����)

A. ԭ�Ӱ뾶����<��<�� B. �����ԣ���>��
C. ����������ԣ���>��>�� D. ��������������>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ҵ���������Ũ���������µķ�Ӧװ����ͼ���ƾ��Ƶ���ͼ�о�����ȥ�����Թ�b��ʢ��________��Һ������һ��ʱ����Թ�b��Һ�Ϸ���һ����״Һ�壬����״Һ���������_________���Ҵ������ᷴӦ�Ļ�ѧ����ʽΪ__________________________________
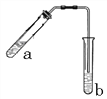
��2��ij����Һ�п��ܺ���Al3����Fe3����Na����NH4����Cl�������ӣ���ͨ������ʵ������е������ӽ��м��飺
��ȡ��������Һ����ϸ�۲죬����ɫ��
������������Һ����εμ�NaOH��Һ�����������а�ɫ�������ɣ����������ȫ�ܽ⡣ʵ������л��д̼�����ζ�������������������ʹʪ��ĺ�ɫʯ����ֽ������
�ݴ˿����жϸô���Һ��һ�����е���������_____��һ��û�е���������____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com