
【题目】下列各组微粒,没有按照半径由小到大顺序排列的是
A. Cl、Na、F、K B. F、Cl、Na、K
C. Ca2+、K+、Cl-、S2- D. Na+、K+、Cl-、Br-
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】(1) 如下图实验装置,当有16.8g铁粉参加反应时,生成的气体在标准状况下的体积是__L。
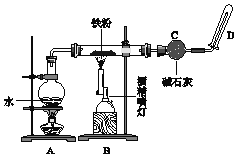
(2) 向Cu和CuO组成的混合物中,加入100mL 6.0mol·L1稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:
①原混合物中Cu和CuO的物质的量之比为______;
②假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为______mol·L1;
③若将生成的NO气体完全溶解,需要标准状况下的氧气的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别( )
A.酚酞试液B.氯化钡溶液C.氢氧化钠溶液D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是( )
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,熵增加的反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程只与焓变有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。
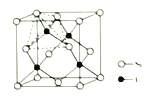
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息回答问题
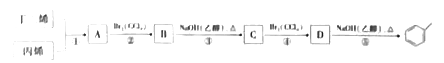
已知:![]()
(1)A中含有的官能团名称是______,A的名称是_____。
(2)不考虑顺反异构,丙烯的二氯代物有____种。
(3)反应类型:①是_________;⑤是_______________。
(4)反应③的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单烯烃A(C8H16)可以发如下图所示的转化,回等下列问题:
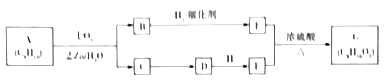
已知:a. 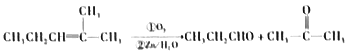
b.B的核磁共振氢谱图中有2个峰,峰面积之比是2:3.
(1)B的分子式为______;E的名称为______,1molE最多加与_____molNa2CO3反应.
(2)写出C![]() D、E+F
D、E+F![]() G反应的化学方程式:___________。
G反应的化学方程式:___________。
(3)A能形成高分子(C8H16)n,平均1molA中含有的甲基数是____(用NA表示阿伏加德罗常数的值)。
(4)B不能发生银镜反应,其同分异构体X能发生银镜反应,X的结构有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________;X、Y形成的含18电子的化合物的电子式____________;
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________;
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置。其实验操作步骤如下:
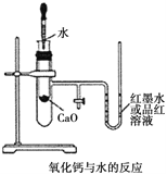
① 按图所示将实验装置连接好;
② 在 U 形管内加入少量红墨水(或品红溶液),打开 T 形管活塞,使 U 形管内两边的液面处于同一水平 面,再关闭 T 形管活塞;
③ 在盛有 1.0g 氧化钙的小试管里滴入 2mL 左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是_____。
(2)实验中观察到的现象是_____。
(3)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:_________。
(4)若该实验中 CaO 换成 NaCl,实验还能否观察到相同现象?_____(填“能” 或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com