
【题目】某单烯烃A(C8H16)可以发如下图所示的转化,回等下列问题:
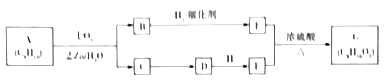
已知:a. 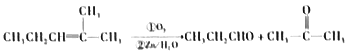
b.B的核磁共振氢谱图中有2个峰,峰面积之比是2:3.
(1)B的分子式为______;E的名称为______,1molE最多加与_____molNa2CO3反应.
(2)写出C![]() D、E+F
D、E+F![]() G反应的化学方程式:___________。
G反应的化学方程式:___________。
(3)A能形成高分子(C8H16)n,平均1molA中含有的甲基数是____(用NA表示阿伏加德罗常数的值)。
(4)B不能发生银镜反应,其同分异构体X能发生银镜反应,X的结构有____种。
【答案】 C5H10O 丙酸 0.5 CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+3NH3+2Ag↓+H2O[或CH3CH2CHO+2Cu(OH)2+NaOH
CH3CH2COONH4+3NH3+2Ag↓+H2O[或CH3CH2CHO+2Cu(OH)2+NaOH![]() CH3CH2COONa+Cu2O+3H2O];CH3CH2CHOHCH2CH3+CH3CH2COOH
CH3CH2COONa+Cu2O+3H2O];CH3CH2CHOHCH2CH3+CH3CH2COOH![]() CH3CH2COOCH(CH2CH3)2+H2O 3nNA 4
CH3CH2COOCH(CH2CH3)2+H2O 3nNA 4
【解析】A氧化后生成B和C,B的核磁共振氢谱图中有2个峰,峰面积之比是2:3,B只能是酮,故为CH3CH2COCH2CH3,故C应该为丙醛,乙醛碱性条件下氧化生成丙酸盐D,D酸化得到E为丙酸,CH3CH2COCH2CH3与氢气发生加成反应生成F为CH3CH2CHOHCH2CH3,CH3CH2CHOHCH2CH3与CH3CH2COOH发生酯化反应生成G为CH3CH2COOCH(CH2CH3)2。(1)B为CH3CH2COCH2CH3,分子式为C5H10O;E为CH3CH2COOH,名称为丙酸,1mol丙酸最多加与0.5molNa2CO3反应;(2)C![]() D、E+F
D、E+F![]() G反应的化学方程式分别为: CH3CH2CHO+2Ag(NH3)2OH
G反应的化学方程式分别为: CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+3NH3+2Ag↓+H2O[或CH3CH2CHO+2Cu(OH)2+NaOH
CH3CH2COONH4+3NH3+2Ag↓+H2O[或CH3CH2CHO+2Cu(OH)2+NaOH![]() CH3CH2COONa+Cu2O+3H2O];CH3CH2CHOHCH2CH3+CH3CH2COOH
CH3CH2COONa+Cu2O+3H2O];CH3CH2CHOHCH2CH3+CH3CH2COOH![]() CH3CH2COOCH(CH2CH3)2+H2O;(3)A能形成高分子(C8H16)n,根据B、C的结构可推知,平均1molA中含有的甲基数是3nNA;(4) B为CH3CH2COCH2CH3,同分异构体可看成是醛基与丁基相连,丁基有4种,故X的结构有4种。
CH3CH2COOCH(CH2CH3)2+H2O;(3)A能形成高分子(C8H16)n,根据B、C的结构可推知,平均1molA中含有的甲基数是3nNA;(4) B为CH3CH2COCH2CH3,同分异构体可看成是醛基与丁基相连,丁基有4种,故X的结构有4种。


科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
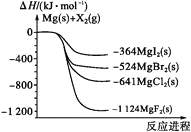
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒,没有按照半径由小到大顺序排列的是
A. Cl、Na、F、K B. F、Cl、Na、K
C. Ca2+、K+、Cl-、S2- D. Na+、K+、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四瓶盛有相同物质的量的NaOH溶液中通入体积不同的CO2气体后,得到①②③④四瓶溶液。分别向四瓶溶液中逐滴加入等浓度的盐酸,产生的气体体积V(CO2)与所加盐酸体积V(HCl)的关系如下图所示,且图②③④中分别有OA<AB、OA=AB、OA>AB,则下列分析与判断正确的是(忽略CO2的溶解)

A. ①中通入的CO2最少 B. ③中的溶质只有Na2CO3
C. 有两种溶质的是②和③ D. 若④中OA>2AB,则有c(NaOH)<c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L,向该混合液中加入1.92g铜粉。待充分反应后,所得溶液中的Cu2+的物质的量是( )
A. 0.45mol B. 0.225mol C. 0.3mol D. 0.0225mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol甲烷和氯气发生取代反应,待反应完成后,测得四种取代物的物质的量相等,则消耗氯气的物质的量为
A.0.5molB.2molC.2.5molD.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某碱性硼化钒(VB2)-空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
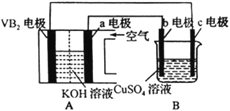
A. VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
C. 外电路中电子由a电极流向b电极
D. 若B装置内的液体体积为400mL,则CuSO4溶液物质的量浓度为0.025mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是: 2Cu2O+Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为________;Cu2O与Cu2S比较,熔点较高的是_____,原因是________。.
(2)SO2与SO3的健角相比,键角更大的是_____,将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1,此固态SO3中S原子的杂化轨道类型是_________;该结构中S-O键长有两类。一类键长约140pm,另一类键长月为160pm,较短的键为_______。(填图中字母)
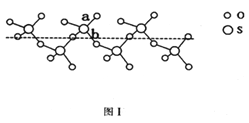
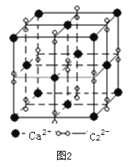
(3)离子化合物CaC2的一种晶体结构如图2所示。该物质的电子式_____。从钙离子看,属于________堆积,其配位数是_________;一个晶胞含有的π键平均有________个。
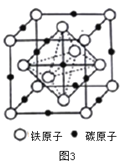
(4)奥氏体是碳溶解γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为________pm (阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com