
【题目】当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.Fe(OH)3胶体B.K2SO4溶液C.蔗糖溶液D.NaCl溶液
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是 ( )
A. 2.4g金属镁所含电子数目为0.2NA B. 16g CH4所含原子数目为NA
C. 17gNH3所含质子数目为10 NA D. 18g水所含分子数目为18NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物也是主要的空气污染物之一,要对其进行处理和再利用。
I.脱硝法:
(1)已知H2的燃烧热△H= -285.8kJ/mol,N2(g) +O2(g)=2NO(g) △H= + 180kJ/mol。一定条件下,H2还原NO生成液态水和一种无毒物质的热化学方程式为_______________________。
II.化合法:
工业上用NO和Cl2化合制备重要的合成用试剂NOCl( 亚硝酰氯)气体。
(2)NOCl中N 元素的化合价为__________,NOCl的电子式为_____________________。
(3)向1L恒容密团容器中通入2molNO(g)和1molCl2(g)发生反应:2NO(g) + Cl2(g)![]() 2NOCl(g) △H,在不同温度下测得c(NOCl)与时间t的关系如图所示。
2NOCl(g) △H,在不同温度下测得c(NOCl)与时间t的关系如图所示。

①该反应的△H_____0(填“>"或“<”或“=”),理由是_____________________。
②温度T1时,Cl2(g)在0~20min的平均反应速率为__________mol/(L·min)。
③温度T2时,该反应的平衡常数K=______(结果保留小数点后2位)。若反应在T2达到平衡后,再向容器中充入2molNO(g)和1molCl2(g),当再达平衡时,c(NOCl)=______(填“>”或“<”或“一”)1mol/L。
III.电化学法:
用下图所示装置可以模拟消除NO2获得铵态氮肥的过程。

(4)该装置阳极电极反应式为____________________________。
(5)电解后,向所得溶液中通入适量NH3可增加铵态氮肥的产量,理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
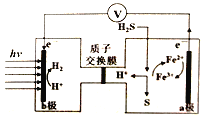
A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。反应时释放大量热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是____________ 。
又知:H2O(g )=H2O (l) △H=-44 kJ·mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为__________kJ。
(2)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是___________________________。
(3)写出分子式为C8H10含苯环的所有同分异构体_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,
② H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是( )
A. 氢氟酸的电离方程式及热效应可表示为:HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在锰系产品中具有重要地位,由软锰矿(MnO2) 和硫铁矿(FeS2)制备流程如下:

(1)从“除质2”后的溶液中得到MnSO4的操作为______、降温结晶、过滤和干燥。
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:

①__________;②__________。提高软锰矿浸出率的措施还有______和_______。
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为______,加入其目的是_________。
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式____________。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?_________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学方程式书写正确的是
A. CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B. ![]() +HO-NO2
+HO-NO2![]()
![]() -NO2+H2O
-NO2+H2O
C. H2C=CH2+Br2![]() CH3CHBr2
CH3CHBr2
D. CH3CH2OH+CH3COOH![]() CH3CH2COOCH3+H2O
CH3CH2COOCH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于N2的叙述错误的是( )
A.N2既可作氧化剂又可做还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物
D.NO和NO2都可稳定存在于空气中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com