
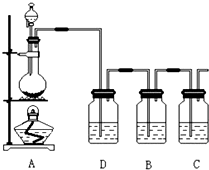
 已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:分析 (1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,根据氯气的制备方法来回答;
(2)用浓盐酸制取氯气的实验过程中要挥发出HCl气体,因此D部分应是除去HCl气体的装置;
(3)要在B中发生氯气置换出硫的反应,结合给定试剂来判断;
(4)从氯原子和硫原子的核外电子排布可知:原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.
解答 解:(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.故答案为:浓盐酸;MnO2;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此D部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.故答案为:饱和食盐水;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓.
故答案为:A;有淡黄色沉淀生成;Na2S+Cl2=2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
点评 本题应从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| 实验方案 | A | B | C | D |
| 图 | 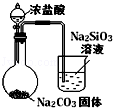 | 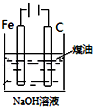 | 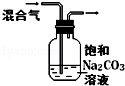 | 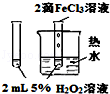 |
| 实验目的 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有一瓶标签受到腐蚀(如图所示)的无色溶液,已知该溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠、硫化钠中的一种,为确定溶液的成分,同学们进行了如下探究:
现有一瓶标签受到腐蚀(如图所示)的无色溶液,已知该溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠、硫化钠中的一种,为确定溶液的成分,同学们进行了如下探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
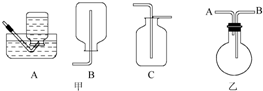
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
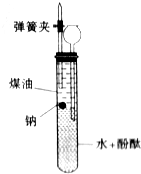 (1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.
(1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
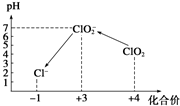
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
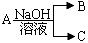 ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com