
【题目】下列物质能导电的是( )
A.石墨
B.葡萄糖
C.氯化钠固体
D.干冰
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素:①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述________(填写编号,下同)决定;对气体物质而言,它主要由上述____________决定。
(2)标准状况下,体积为11.2 L的CO2的质量________g,其所含原子的总数是________个。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,仪器使用不正确的是( )
A. 熄灭酒精灯用灯帽盖灭
B. 加热烧杯时垫石棉网
C. 在量筒中稀释浓硫酸
D. 制取乙烯时,温度计插入混合液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了氯气的相关知识之后,某化学兴趣小组用下图所示仪器及试剂,进行了实验室制取氯气实验,并探究其相关化学性质。
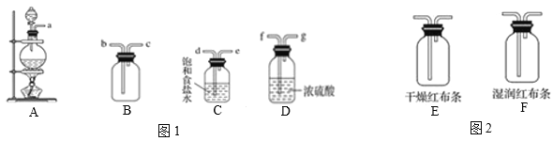
(1)若A中药品为MnO2和浓盐酸,请写出实验原理_____________________(用化学方程式表示)。
(2)将图1各仪器按先后顺序连接起来___________(用导管口处的字母表示)。
(3)C装置的作用_____________________。
(4)验满的方法为_____________________。
(5)把Cl2分别通入图2装置E和F,可以观察到什么现象______________________________;实验目的:_____________________。
(6)实验室除了可以用MnO2和浓盐酸制取Cl2,还可以用哪些药品与浓盐酸反应制取_______________________(用化学方程式表示其反应原理)
(7)该实验有哪些不足之处_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
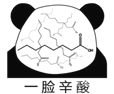
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量回答下列问题:
(1)配平以下离子方程式,并用单线桥表示电子转移的方向和数目:
______+_____MnO4-+_____H2C2O4=_____CO2↑+_____Mn2++____。
(2)该反应中的还原剂是______。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为______mol。
(4)将一定质量的镁、铝合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如下图。
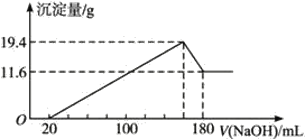
①原合金中铝的质量分数是___________。
②盐酸的物质的量浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。

①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。

①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的电子排布式为________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因是________________________________________________________________________。
(3)D元素与氟元素相比,电负性:D________(填“>”“=”或“<”)F,下列表述中能证明这一事实的是______(填选项序号)。
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物CA5含有的化学键类型为________。
(5)B2A4是重要的石油化工原料,B2A4的结构式为________。B2A4通过聚合反应可以生成一种有机高分子化合物,反应方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com