
| A、②④⑤ | B、②③④ |
| C、①②③ | D、②③⑤ |
| m |
| n |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
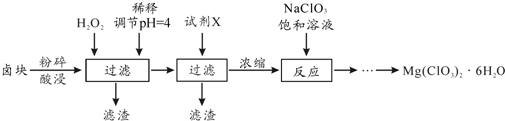
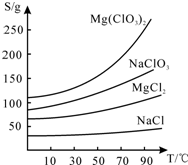
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L CCl4中含有的C-Cl键的个数为2NA |
| B、1 mol Na2O和Na2O2物中含有的阴、阳离子总数是3 NA |
| C、常温下,0.1 mol Cl2通入NaOH溶液中充分反应,转移电子数为0.2 NA |
| D、1 L 0.1 mol?L-1氨水溶液中所含的离子和分子总数大于0.1 NA但小于0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、硫酸 |
| C、NaOH固体 |
| D、水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、加入少量0.1mol?L-1HCl溶液,溶液中C(H+)增大 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲 | B、乙 | C、丙 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据能量守恒定律,生成物总能量一定等于反应物总能量 |
| B、放热反应的反应速率一定大于吸热反应的反应速率 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com