
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各为0.4mol。将A通入溴的四氯化碳溶液中,溶液褪色(反应原理与通入溴水一样),试回答:
(1)烃A的结构式为_________________________________。
(2)将A通入溴的四氯化碳溶液中,有关反应的方程式为_______________________。
(3)有机物B比A在分子组成上多一个CH2原子团,结构与A相似。写出B在一定条件下生成高分子化合物的化学方程式________________________________________________。
(4)写出苯与液溴反应的化学方程式_________________________________________。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
①CH3CH2CH3+Br2![]() CH3CH2CH2Br+HBr
CH3CH2CH2Br+HBr
②C4H10+![]() O2
O2![]() 4CO2+5H2O
4CO2+5H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①② B. ①③④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a中放置附着氧化铜粉末的石棉绒,向a中持续通入气态物质X,可以观察到石棉绒上黑色粉末变成红色固态物质,同时c处的U形管中有无色液体生成(假设X气体全部反应,各处反应均完全)。
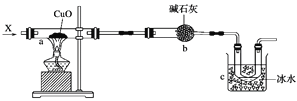
(1)写出a处反应的化学方程式:_______________________________________________。
(2)c处液体主要成分的结构简式为__________________________;检验该物质的操作步骤是_________________________________,其现象为______________________________;有关反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. “臭氧空洞”、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
B. 工业海水制取镁流程:海水![]() Mg(OH)2→MgCl2
Mg(OH)2→MgCl2![]() Mg
Mg
C. 推广使用乙醇汽油代替汽油目的是为了减少温室气体的排放
D. 工业生产玻璃、水泥都用石灰石做原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是( )

A. 对于达到平衡状态的N2(g)+3H2(g)![]() 2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
B. P2>P1,T1>T2
C. 该图象表示的方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g)![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在农村,有些地区由于使用了没有保护措施的铁制自来水管,导致水中含有Fe3+,用这种水泡的茶,茶水的颜色略带黑色。我们可以在这种水中加入下列哪种溶液使得溶液呈红色来检验Fe3+( )
A.K2SB.KCNC.KSCND.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
A. 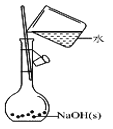 配制0.10mol/LNaOH溶液
配制0.10mol/LNaOH溶液
B. 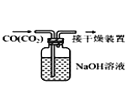 除去CO中的CO2
除去CO中的CO2
C. 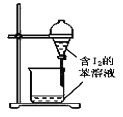 苯萃取碘水中的I2,分出水层后的操作
苯萃取碘水中的I2,分出水层后的操作
D. 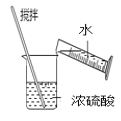 稀释浓硫酸
稀释浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机物质的分子式采取适当变形会简化计算.下列计算中错误的是( )
A. 等质量的甲烷、乙烯、乙炔充分燃烧,消耗的氧气的物质的量依次增多
B. Wg葡萄糖充分燃烧后,燃烧产物经过足量的Na2O2充分反应,固体质量增加Wg
C. 乙酸和两种链状单烯烃混合物中氧的质量分数为a,则碳的质量分数是6/7(1-a)
D. 等物质的量的乙醇与丙烯酸![]() 充分燃烧,消耗的氧气的物质的量相同
充分燃烧,消耗的氧气的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
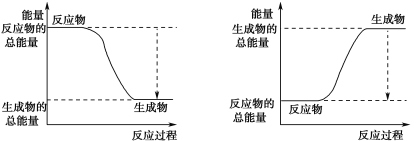
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com