
【题目】(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是___(用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的____(填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
(2)某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
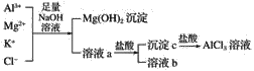
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:___,__,___。
②氢氧化钠溶液能否用氨水代替,为什么?___。
③溶液a中存在的离子有___,在溶液a中加入盐酸时需控制盐酸的量,为什么?___,为此,改进方法是___。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ c Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O(或者写Al3++4OH-=AlO2-+2H2O) 不能,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开 Cl-、K+、AlO2-、OH-、Na+ 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制盐酸的量,以防止部分AlO2-转化成Al3+ 通入过量二氧化碳气体
【解析】
(1)铝材表面的Al2O3与碱反应后,Al会与碱反应生成氢气;
(2)Al3+、Mg2+会与OH-反应生成沉淀,但是Al(OH)3会溶于过量的碱,转化为AlO2-,AlO2-与酸反应生成Al(OH)3。
(1)冒气泡的原因是表面Al2O3与碱液反应后Al与强碱溶液反应生成H2,碱洗液中Al元素以AlO2-形式存在,为防止Al(OH)3溶解,应通入CO2使AlO2-转化为Al(OH)3,答案是2Al+2OH-+2H2O=2AlO2-+3H2↑ c;
(2)①加入足量氢氧化钠溶液,Mg2+可与OH-反应生成Mg(OH)2沉淀,Al3+先与OH-反应生成Al(OH)3,生成的Al(OH)3继续与OH-反应生成NaAlO2和H2O;答案为Mg2++2OH-=Mg(OH)2↓; Al3++3OH-=Al(OH)3↓ ;Al(OH)3+OH-=AlO2-+2H2O(或者写Al3++4OH-=AlO2-+2H2O);
②氢氧化钠溶液不能用氨水代替,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开;
③加入氢氧化钠溶液后除去了Mg2+,但又引入了Na+,同时Al3+转化成了AlO2-;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制溶液的pH,以防止部分AlO2-转化成Al3+;氢氧化铝只能与强碱或强酸反应,因此,可在溶液a中通入过量二氧化碳气体。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
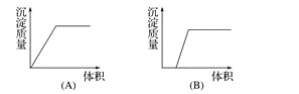
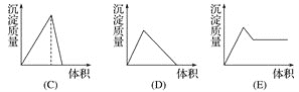
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化钌是一种重要的贵金属化合物,广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。
I.三氯化钌的制备
将金属钌粉与氯化钠混合后,加入微量还原性淀粉,将温度升高到800~1000°C,再往熔融的熔体中通入氯气,大部分钌粉转化为氯钌酸钠(Na2RuCl6),再经过一系列化学工艺制备出三氯化钌。
(1)生成氯钌酸钠的化学方程式为__________________
(2)升温阶段加入还原性淀粉的作用是__________________
II.三氯化钌的回收
从废弃催化剂回收三氯化钌的一种工艺流程如下图所示:
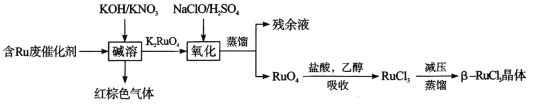
回答下列问题:
(3)“氧化”时加H2SO4的目的______________________
(4)“吸收”过程中加入乙醇的作用是__________________________
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2==2Ru+6HCl。某同学对产品纯度进行测定,所得数据记录如下:

则产品的纯度为________(用百分数表示,保留两位有效数字)
(6)钌及其化合物在合成工业.上有广泛用途,下图是用钌( Ru)基催化剂催化合成甲酸的过程。每生成92g液态HCOOH放出62.4kJ的热量。
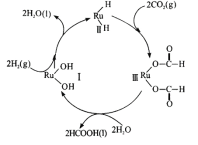
①根据图示写出该反应的热化学方程式_______________
②下列说法正确的是________
a.图示中物质I为该反应的催化剂
b.图示中参与循环的物质只有CO2和H2
c.反应的活化能为62.4 kJ·mol -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 2 min末的反应速率v(C)=0.3 mol·L-1·min-1
C. 2 min内D的物质的量增加0.2mol
D. 若起始时A、B的物质的量之比为4:3,则2 min末A、B的转化率之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
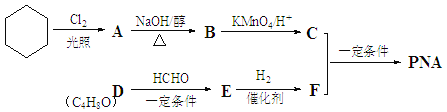
【题目】PNA是一种具有良好的热稳定性、耐腐蚀性和抗水性的高分子化合物,常用作增塑剂,其合成路线如下图所示:
已知:
① R1CH=CHR2![]() R1COOH + R2COOH (R1、R2代表烃基)
R1COOH + R2COOH (R1、R2代表烃基)
②
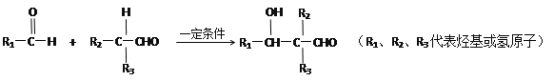
请回答:
(1)A分子中只有一个氯原子,A→B的化学方程式是 。
(2)C含有的官能团名称是 。
(3)D能发生银镜反应,且分子中有支链, D的结构简式是 。
(4)E→F的反应类型是 。
(5)E的结构简式是 。
(6)C与F在一定条件下生成增塑剂PNA的反应的化学方程式是: 。
(7)香豆素是一种重要的香料,与C具有相同的相对分子质量;14.6 g香豆素完全燃烧
生成39.6 g CO2和5.4 g H2O。
①香豆素的分子式是 。
②写出所有符合下列条件的香豆素的同分异构体的结构简式 。
a. 分子中含有![]() 基团
基团
b. 分子中除一个苯环外,无其他环状结构
c. 苯环上的氢原子被氯原子取代,得到两种一氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
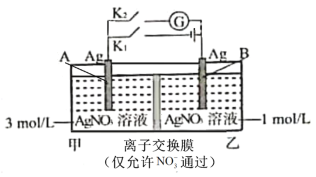
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
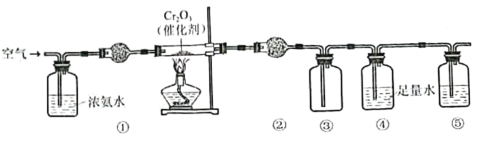
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
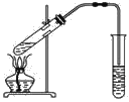
(1)写出左试管中主要反应的化学方程式:_________________________________。
(2)加入浓硫酸的作用:_________________。
(3)反应开始时用酒精灯对左试管小火加热的原因是____________________________(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃);后改用大火加热的目的是______。
(4)分离右试管中所得乙酸乙酯和饱和Na2CO3溶液的操作为________(只填名称),所需主要仪器为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法不正确的是( )
为阿伏加德罗常数的值。下列说法不正确的是( )
A.![]() 与过量浓硝酸反应,收集到
与过量浓硝酸反应,收集到![]() 气体(标准状况),则被还原的硝酸的数目是0.06NA
气体(标准状况),则被还原的硝酸的数目是0.06NA
B.常温常压下,![]() 的乙二酸溶液中,总的离子数目大于0.15NA
的乙二酸溶液中,总的离子数目大于0.15NA
C.常温常压下,![]() 与足量
与足量![]() 反应,共生成
反应,共生成![]() 转移电子的数目为0.4NA
转移电子的数目为0.4NA
D.含![]() 与
与![]() 共
共![]() 的溶液中,N(
的溶液中,N(![]() )+N
)+N![]() )+N(H2CO3)=NA
)+N(H2CO3)=NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com