
【题目】三氯化钌是一种重要的贵金属化合物,广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。
I.三氯化钌的制备
将金属钌粉与氯化钠混合后,加入微量还原性淀粉,将温度升高到800~1000°C,再往熔融的熔体中通入氯气,大部分钌粉转化为氯钌酸钠(Na2RuCl6),再经过一系列化学工艺制备出三氯化钌。
(1)生成氯钌酸钠的化学方程式为__________________
(2)升温阶段加入还原性淀粉的作用是__________________
II.三氯化钌的回收
从废弃催化剂回收三氯化钌的一种工艺流程如下图所示:
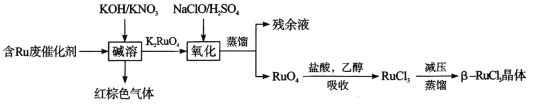
回答下列问题:
(3)“氧化”时加H2SO4的目的______________________
(4)“吸收”过程中加入乙醇的作用是__________________________
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2==2Ru+6HCl。某同学对产品纯度进行测定,所得数据记录如下:

则产品的纯度为________(用百分数表示,保留两位有效数字)
(6)钌及其化合物在合成工业.上有广泛用途,下图是用钌( Ru)基催化剂催化合成甲酸的过程。每生成92g液态HCOOH放出62.4kJ的热量。
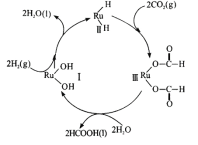
①根据图示写出该反应的热化学方程式_______________
②下列说法正确的是________
a.图示中物质I为该反应的催化剂
b.图示中参与循环的物质只有CO2和H2
c.反应的活化能为62.4 kJ·mol -1
【答案】Ru+2Cl2+2NaCl![]() Na2RuCl6 保持还原性反应环境,防止金属钌被空气中氧气氧化 NaClO在酸性环境下氧化性增强 增加RuO4在溶液中的溶解性 82% H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 a
Na2RuCl6 保持还原性反应环境,防止金属钌被空气中氧气氧化 NaClO在酸性环境下氧化性增强 增加RuO4在溶液中的溶解性 82% H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 a
【解析】
II.含Ru废催化剂加入KOH/KNO3混合溶液浸取,硝酸根在碱性环境下将Ru元素氧化为K2RuO4,自身被还原成红棕色气体NO2,之后再加入硫酸酸化的次氯酸钠,将K2RuO4氧化为RuO4,蒸馏得到RuO4,加盐酸和乙醇混合液进行吸收,得到RuCl3溶液,之后进行减压蒸馏得到β—RuCl3晶体;
Ⅲ.H2和物质I反应生成水和物质Ⅱ,之后物质II和CO2反应生成物质Ⅲ,之后物质Ⅲ和水反应生成物质I和HCOOH,所以物质I为催化剂,氢气和二氧化碳为反应物
I.(1)根据题意反应物有Ru、NaCl以及氯气,产物有Na2RuCl6,该过程中Ru元素被氧化成+4价,Cl元素被还原成-1价,根据电子守恒和元素守恒可得化学方程式为Ru+2Cl2+2NaCl![]() Na2RuCl6;
Na2RuCl6;
(2)空气中的氧气具有氧化性,升温阶段加入还原性淀粉可以保持还原性反应环境,防止金属钌被空气中氧气氧化;
II.(3)酸性环境下可以增强NaClO的氧化性;
(4)加入乙醇可以增大RuO4在溶液中的溶解度;
(5)根据三组实验数据得到的Ru单质的平均质量为![]() =0.500g,根据方程式可知样品中RuCl3的质量为
=0.500g,根据方程式可知样品中RuCl3的质量为![]() =1.0272g,则样品的纯度为
=1.0272g,则样品的纯度为![]() =82%;
=82%;
(6)①根据整个流程可知,CO2和H2为反应物,产物为HCOOH,92gHCOOH的物质的量为![]() =2mol,所以生成1mol液体HCOOH放出31.2kJ能量,热化学方程式为H2(g)+CO2(g)=HCOOH(l)△H=-31.2kJ·mol-1;
=2mol,所以生成1mol液体HCOOH放出31.2kJ能量,热化学方程式为H2(g)+CO2(g)=HCOOH(l)△H=-31.2kJ·mol-1;
②a.据图可知物质I虽然参与整个过程,但整个反应前后没有变化,且反应从物质I和氢气的反应开始,所以为该反应的催化剂,故a正确;
b.据图可知催化剂虽然整个过程前后质量和化学性质没有变化,但也参与了整个循环,故b错误;
c.每生成2mol HCOOH放出62.4kJ的能量,据此可知反应物和生成物的能量之差,不能确定反应的活化能,故c错误;
综上所述选a。


 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,![]() 苯中含有
苯中含有![]() 个苯分子
个苯分子
B.标准状况下,![]() 分别与足量的铁和铜充分反应,转移的电子总数之比为
分别与足量的铁和铜充分反应,转移的电子总数之比为![]()
C.![]() 溶液中,阳离子和阴离子的数目之比为
溶液中,阳离子和阴离子的数目之比为![]()
D.![]() 中含有的共价键数为
中含有的共价键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
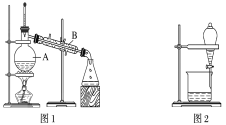
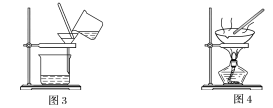
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃、101kPa):
①C4H10(g)+![]() O2(g)═ 4CO2(g)+5H2O(l);△H=-2 878kJ/mol
O2(g)═ 4CO2(g)+5H2O(l);△H=-2 878kJ/mol
②C4H10(g)+![]() O2(g)═ 4CO2(g)+5H2O(g);△H=-2 658kJ/mol
O2(g)═ 4CO2(g)+5H2O(g);△H=-2 658kJ/mol
③C4H10(g)+![]() O2(g)═ 4CO(g)+5H2O(l);△H=-1 746kJ/mol
O2(g)═ 4CO(g)+5H2O(l);△H=-1 746kJ/mol
④C4H10(g)+![]() O2(g)═ 4CO(g)+5H2O(g);△H=-1 526kJ/mol
O2(g)═ 4CO(g)+5H2O(g);△H=-1 526kJ/mol
由此判断,正丁烷的燃烧热为( )
A.2878kJ/molB.2658kJ/molC.1746kJ/molD.1526kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O(g)=CO(g)ΔH1 ; C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2 (g)=SO2 (g) ΔH3 ; S(g)+O2 (g)=SO2 (g) ΔH4
③H2(g)+ ![]() O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)。经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的化学反应速率为____________,X的转化率为__________,Z的平衡浓度为_______________。
Y(g)+3Z(g)。经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的化学反应速率为____________,X的转化率为__________,Z的平衡浓度为_______________。
Ⅱ.一定温度下,反应N2(g)+O2(g)![]() 2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
(1)缩小体积使压强增大:__________;
(2)恒容充入N2:__________;
(3)恒容充入He:__________;
(4)恒压充入He:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1.4gC2H4、C3H6 的混合气体中,所含碳原子总数为 0. lNA
B. 1.0 mol CH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA
C. 标准状况下,22. 4LC2H6 中所含极性共价键的数目为 7NA
D. 50mL l2mol·L 的浓盐酸与足量 MnO2 反应,转移电子总数为 0. 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是___(用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的____(填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
(2)某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
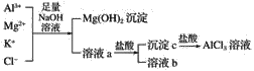
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:___,__,___。
②氢氧化钠溶液能否用氨水代替,为什么?___。
③溶液a中存在的离子有___,在溶液a中加入盐酸时需控制盐酸的量,为什么?___,为此,改进方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com