
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
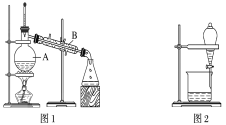
(1)װ��ͼ1��B��������________________��ͼ2��©����������________________��A��һ��Ҫ�������Ƭ����������__________________________�����й�������ʵ�����˵��һ����ȷ����_��
A��ͼ1ʵ���У�����һ��ʱ�����δ�������Ƭ��Ӧ�������ӣ��Է�����Σ��
B��ͼ2ʵ���У�Ӧ���������л��ܼ����¶˵����зų�
C��ͼ3ʵ���У������ò�������©���н��裬�Լӿ�����ٶ�
D��ͼ4ʵ���У����������н϶��������ʱ����ֹͣ����
(2)����һƿA��B�Ļ��Һ����֪���ǵ��������±���
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 | �ܽ��� |
A | ��11.5 | 198 | 1.11 | A��B���ܣ��Ҿ�������ˮ�;ƾ� |
B | 17.9 | 290 | 1.26 |
�ݴ˷�������A��B������ѡ����ͼ�е�ͼ________________��ʾ������
(3)��ͼ2��ʾʵ���У����÷ֲ�������֪����һ��Һ������ˮ�����������һ�ּ����жϷ�����____��
���𰸡�(ֱ��)������ �����ͣ���Һ©�� ��ֹҺ�屩�� D 1 ������©���м�������ˮ��������ӵ�Һ�����ˮ��(������������Ҳ��)
��������
��1������ͼ1װ��ͼ��BΪ(ֱ��)�����ܣ�ͼ2��©��Ϊ��Һ©����A�м������Ƭ���ʯ���������Ƿ�ֹҺ�屩�У�
A��ͼ1ʵ���У�����һ��ʱ���δ�������Ƭ��Ӧֹͣ���ȣ���ȴ���ٷ������Ƭ���ʯ����A����
B����Һʱ��Ӧ�ȴ�Һ©����ƿ����Ȼ����������²�Һ����¿��������ϲ�Һ����Ͽڵ�����ͨ�����⣬��֪�л������²㻹���ϲ㣬��B����
C������ʱ�����������������������ܽ��裬��Ҫ���ӹ��˵��ٶȣ����Բ��ó��˵ķ�������C����
D�������ᾧ�У����д�����������ʱ��ֹͣ���ȣ�����������ˮ�֣���D��ȷ��
��ѡD��
��2�����ݱ����е����ݣ������£�A��B���ֻ���Һ�壬������е㲻ͬ����������ķ������з�������ѡ��ͼ1��
��3��ȷ����һ��Ϊˮ�㣬���Բ��ü�����©���м���������ˮ����������Һ��Ϊˮ�㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���ֲ�ͬ����֮�������ͼ��ʾת����ϵ(��Ӧ���������ֲ�������ȥ)�������й����ʵ��ƶ�����ȷ���� (����)

ѡ�� | ���� | ���� |
A | AΪNaOH��Һ | D������CO2 |
B | BΪCO | C������CO2 |
C | CΪFeCl2����DΪFe | A���������� |
D | CΪSO2 | A������H2S |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����д��ȷ���ǣ�������
A.����ʯ�����ᷴӦ��CO32��+2H+=CO2��+H2O
B.ͭ����������Һ��Ӧ��Cu+Ag+=Cu2++Ag
C.��������ˮ��Cl2+H2O�T2H++Cl��+ClO��
D.����������������Һ��Ӧ��2H++SO42��+Ba2++2OH��=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g) + O2(g) ![]() 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
�� | �� | �� | ||
��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2��ƽ��ת���� / % | 80 | ��1 | ��2 | |
A. ���з�Ӧ��ƽ�ⳣ��С����
B. ƽ��ʱ������c(SO3)�Ǽ��е�2��
C. ���¶��£�ƽ�ⳣ��ֵΪ400
D. ƽ��ʱ������O2��ת���ʴ�������O2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƚ�����ͭ�Ľ����ԣ�������ѡ���Լ������ʵ���
A.ϡ���ᣬ��Ƭ��ͭƬ
B.�Ȼ�������Һ��ͭƬ
C.�Ȼ�����Һ��ͭƬ
D.�Ȼ�ͭ��Һ����Ƭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25Cʱ�������Ϊ2L���ܱ������У���̬����A��B��C�����ʵ���n��ʱ��1�ı仯��ͼ1��ʾ����֪��Ӧ�ﵽƽ������¶ȣ�A��ת���ʽ�����

(1)����ͼ1���ݡ�д���÷�Ӧ�Ļ�ѧ����ʽ��_____________���˷�Ӧ��ƽ�ⳣ������ʽΪK=_________���ӷ�Ӧ��ʼ����һ��ƽ��ʱ��ƽ������v(A)Ϊ________��
(2)��5~7min�ڣ���Kֵ���䣬��˴����߱仯��ԭ����_________��
(3)ͼ2��ʾ�˷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵ��t3��t5��t6ʱ�̸��ı�һ���һ�����ͬ�����������ε�ƽ�ⳣ�����±���ʾ��K1��K2��K3��K4֮��Ĺ�ϵΪ________���á�>����<����=�����ӣ���A��ת��������һ��ʱ����___________��
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4��������ӦN2O4��g��2NO2��g�������¶ȵ����ߣ�����������ɫ����ش��������⣺
��1����Ӧ����H___0����������������С��������100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60sʱ�Σ���Ӧ����v��N2O4��Ϊ___molL��1s��1��

��2��100��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c��N2O4����0.0020molL��1s��1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⡣T___100������������������С���������ж�������_______________________��
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ����___����������Ӧ�������淴Ӧ���������ƶ���
��4����2NO2N2O4�Ŀ��淴Ӧ�У�����״̬һ������ƽ��״̬���ǣ�____��
A��N2O4��NO2�ķ�������Ϊ1��2 B��N2O4��NO2��Ũ�����
C��ƽ����ϵ����ɫһ�����ٸı�D����λʱ����1molN2O4��ΪNO2��ͬʱ����2molNO2��ΪN2O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ���Ϊ���ִ���ҵ���������˼�����ά����������ҵ�ϳ���ͭ������(��Ҫ�ɷ���Cu2Te����Ag��Au������)Ϊԭ����ȡ�ڲ����ս����乤���������£�
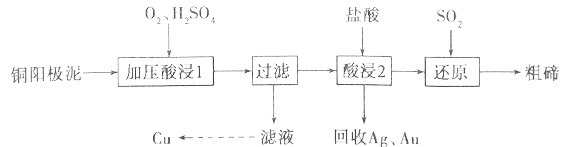
��֪��TeO2���������������ˮ�������ڽ�Ũ��ǿ���ǿ��ش��������⣺
��1������ѹ���1�������н���Ԫ��ת����TeO2��Ӧ������Һ��pHΪ4.5~5.0����Ȳ��ܹ��ߣ�ԭ����__________________________����������ѹ����Ŀ����______________________��д������ѹ���1��������Cu2Te������Ӧ�Ļ�ѧ����ʽ_________________________________��
��2�������2��ʱ�¶ȹ���ʹ�ڵĽ����ʽ��ͣ�ԭ��Ϊ______________________��Ҫ��Ag��Au�з����Au����������յ�Ag��Au�м�����Լ���______________________��
��3��д������ԭ����Ӧ�з��������ӷ���ʽ_________________________________��
��4����ҵ����һ����ȡ�ڵķ����ǽ�ͭ�������ڿ����б��գ�ʹ��ת����TeO2���ټ�NaOH�������ʯīΪ�缫�����Һ���Te���������������ĵ缫��ӦʽΪ_________________________________��
��5��25��ʱ����1mol/L��Na2TeO3��Һ�еμ����ᣬ����ҺpHֵԼΪ6ʱ����ʱ��Һ��c(TeO32��)��c(HTeO3��)=___________(��֪��H2TeO3��Ka1=1.0��10��3��Ka2=2.0��10��8)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��Ԫ��ԭ�ӵ�L���������M���������2��������Ԫ���� ( )
A. �� B. ̼ C. þ D. ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com