
����Ŀ���ڱ���Ϊ���ִ���ҵ���������˼�����ά����������ҵ�ϳ���ͭ������(��Ҫ�ɷ���Cu2Te����Ag��Au������)Ϊԭ����ȡ�ڲ����ս����乤���������£�
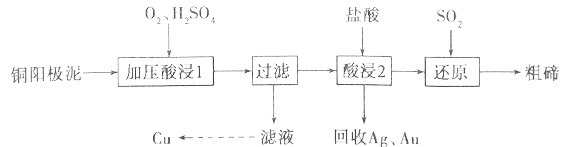
��֪��TeO2���������������ˮ�������ڽ�Ũ��ǿ���ǿ��ش��������⣺
��1������ѹ���1�������н���Ԫ��ת����TeO2��Ӧ������Һ��pHΪ4.5~5.0����Ȳ��ܹ��ߣ�ԭ����__________________________����������ѹ����Ŀ����______________________��д������ѹ���1��������Cu2Te������Ӧ�Ļ�ѧ����ʽ_________________________________��
��2�������2��ʱ�¶ȹ���ʹ�ڵĽ����ʽ��ͣ�ԭ��Ϊ______________________��Ҫ��Ag��Au�з����Au����������յ�Ag��Au�м�����Լ���______________________��
��3��д������ԭ����Ӧ�з��������ӷ���ʽ_________________________________��
��4����ҵ����һ����ȡ�ڵķ����ǽ�ͭ�������ڿ����б��գ�ʹ��ת����TeO2���ټ�NaOH�������ʯīΪ�缫�����Һ���Te���������������ĵ缫��ӦʽΪ_________________________________��
��5��25��ʱ����1mol/L��Na2TeO3��Һ�еμ����ᣬ����ҺpHֵԼΪ6ʱ����ʱ��Һ��c(TeO32��)��c(HTeO3��)=___________(��֪��H2TeO3��Ka1=1.0��10��3��Ka2=2.0��10��8)
���𰸡���Һ���Թ�ǿ��TeO2��������ᷴӦ������Ԫ����ʧ ����O2Ũ��,�ӿ췴Ӧ���ʣ���߽����� Cu2Te+2O2+2H2SO4![]() 2CuSO4+TeO2+2H2O (2��) �¶����ߣ�����ӷ�����Ӧ��Ũ�Ƚ��ͣ����½����ʽ��� ϡ���� Te4+��2SO2��4H2O==Te����2SO42-��8H+ TeO32-+3H2O+4e-=Te+6OH- 1�U50
2CuSO4+TeO2+2H2O (2��) �¶����ߣ�����ӷ�����Ӧ��Ũ�Ƚ��ͣ����½����ʽ��� ϡ���� Te4+��2SO2��4H2O==Te����2SO42-��8H+ TeO32-+3H2O+4e-=Te+6OH- 1�U50
��������
TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ���ҵ�ϳ���ͭ�����ࣨ��Ҫ����TeO2������Ag��Au��Ϊԭ���Ʊ������ڣ���������Ҫ����TeO2������Ag��Au,������������TeO2�ܽ⣬���˵õ�����Ϊ�����ڼ��Ag��Au����Һ�м����������,���˵õ�TeO2�����������ܽ��ͨ���������ԭ�õ������ڡ�
��1������ѹ���1�������н���Ԫ��ת����TeO2��Ӧ������Һ��pHΪ4.5~5.0����Ȳ��ܹ��ߣ�ԭ���ǣ�TeO2�������������Һ���Թ�ǿTeO2�������H2SO4��Ӧ�����°�Ԫ����ʧ������ѹ���������̵����ӷ���ʽΪ��Cu2Te+2O2+4H��=2Cu2��+TeO2+2H2O����������ѹ����Ŀ���ǣ�����O2Ũ��,�ӿ췴Ӧ���ʣ���߽�����������ѹ���1��������Cu2Te������Ӧ�Ļ�ѧ����ʽΪCu2Te+2O2+2H2SO4![]() 2CuSO4+TeO2+2H2O��
2CuSO4+TeO2+2H2O��
��2�������2��ʱ�¶ȹ���ʹ�ڵĽ����ʽ��ͣ���Ϊ�¶����ᵼ������ӷ����࣬��Ӧ��Ũ�Ƚ��ͣ����½����ʽ��ͣ�Ҫ��Ag��Au�з����Au����Ϊ�����������ᣬ�����������ᣬ�ʿ�������յ�Ag��Au�м�����Լ���ϡ���ᡣ
��3������ԭ����Ӧ��������Te4+��ԭΪTe�����������ӷ���ʽTe4+��2SO2��4H2O==Te����2SO42-��8H+��
��4����ҵ�ϻ����Խ�ͭ���������ա������õ�Na2TeO3��Ȼ��ͨ�����ķ����õ������ڡ���֪���ʱ�ĵ缫��Ϊʯī������������ԭ��Ӧ��TeԪ�ػ��ϼ۴�+4��Ϊ0�ۣ��������ĵ缫��ӦʽΪTeO32��+3H2O+4e��=Te+6OH����
��5��25��ʱ����1mol/L��Na2TeO3��Һ�еμ����ᣬ����ҺpHֵԼΪ6ʱ��c��H����=1.0��10-6mol��L��1��Ka2=c(TeO32��)��c(H��)/c(HTeO3��)=2.0��10-8����c��HTeO3������c��TeO32����=c��H������Ka2=1.0��10-6��2.0��10-8=50��1��c(TeO32��)��c(HTeO3��)=1��50.


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����п��ܺ���Na+��K+��Mg2+��Ba2+�� SO42-��CO32-��SO32-��SiO32-�����ӣ��������100mL��Һ��ѧ���о���ѧϰС��Ϊ��ȷ����ɷ֣���Ʋ��������ͼ��ʾʵ�飺

��ش��������⣺
��1��ʵ������ؼ�������������������Һ��ӽ�����ƿ�̶���1-2cm����________�ٽ�����ƿ���Ǻã��������µߵ���ҡ�ȡ�
��2����������ʵ��ɵó���һ�����ڵ�������________��һ�������ڵ�������________
��3)����ʵ����۷�����ʵ����________________
A���ù����п��ܺ���Na2SiO3��K2CO3
B���ù�����һ������Na2SiO3��K2CO3
C���ù����п��ܺ���Na2SiO3��K2CO3��K2SO4
D���ù����п���ֻ����Na2SiO3��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
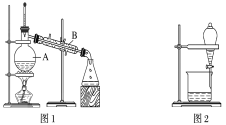
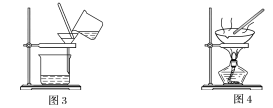
(1)װ��ͼ1��B��������________________��ͼ2��©����������________________��A��һ��Ҫ�������Ƭ����������__________________________�����й�������ʵ�����˵��һ����ȷ����_��
A��ͼ1ʵ���У�����һ��ʱ�����δ�������Ƭ��Ӧ�������ӣ��Է�����Σ��
B��ͼ2ʵ���У�Ӧ���������л��ܼ����¶˵����зų�
C��ͼ3ʵ���У������ò�������©���н��裬�Լӿ�����ٶ�
D��ͼ4ʵ���У����������н϶��������ʱ����ֹͣ����
(2)����һƿA��B�Ļ��Һ����֪���ǵ��������±���
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 | �ܽ��� |
A | ��11.5 | 198 | 1.11 | A��B���ܣ��Ҿ�������ˮ�;ƾ� |
B | 17.9 | 290 | 1.26 |
�ݴ˷�������A��B������ѡ����ͼ�е�ͼ________________��ʾ������
(3)��ͼ2��ʾʵ���У����÷ֲ�������֪����һ��Һ������ˮ�����������һ�ּ����жϷ�����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ka(CH3COOH)=1.7��10��5�����¶��£���0.1mol/L�Ĵ�����Һ�ζ�10.00mL 0.1mol/L��MOH��Һ���ζ������м��������Һ�����(V)����Һ��lg[c(H+)/c(OH��)]�Ĺ�ϵ��ͼ��ʾ(V=0ʱ��lg[c(H+)c(OH��)]=��12)������˵������ȷ����
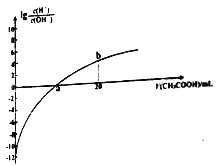
A. MOH��һԪǿ��
B. a �㣺V(CH3COOH)=10.00mL
C. b R��c(M+)>(CH3COOH)>C(H+)>c(OH��)
D. 25��ʱ��CH3COO����ˮ��ƽ�ⳣ��ԼΪ5.9��10��10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ���ǣ� ��
A.14C�к���14������B.16O��18O��ͬһ�ֺ���
C.1H2��2H2����ͬλ��D.C60��C70��Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˫���ŷ���ʾ���з�Ӧ������ת������������д�����ӷ���ʽ��3Cu��8HNO3=3Cu(NO3)2��2NO����4H2O��________________________,���ӷ���ʽΪ________________________����3.84gCu������ʱ��__________gHNO3����ԭ��������״���µ�����________L,ת�Ƶ�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ���Ե�����Һ��,�����������ܹ������������( )
A.Na+��K+��OH-��Cl-B.Mg2+��Cu2+��SO42-��Cl-
C.K+��Ba2+��Cl-��HCO3-D.NH4+��Ba2+��Fe3+��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Na2O2�ĵ���ʽ____________________
��2��д��������Ԫ������Ԫ�ط���__________,��Ԫ�ص��ʵı���Һ��ɫΪ______________��
��3��д��ľ̿��Ũ���Ṳ��ʱ�����Ļ�ѧ��Ӧ����ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ص�ԭ�Ӻ�������Ų��У�������������ϵĵ�������ȵ���
A. �� B. � C. þ D. ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com