
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有______(填字母序号)。
,该配离子中含有的化学键类型有______(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是__(填化学式,写一种)。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
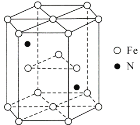
【答案】X-射线衍射 1s22s22p63s23p63d104s1 Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定 16 ABD 10 CN-(或C22-) ![]()
【解析】
(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)根据构造原理可书写出基态铜原子的电子排布式;
(3)根据原子核外电子的轨道上电子处于全满、半满或全空时是稳定状态分析;结合O原子数目及Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(4)Cu2+与乙二胺(H2N-CH2-CH2-NH2)中N原子形成配位键,H2N-CH2-CH2-NH2中C原子之间形成非极性键、不同原子之间形成极性键;单键为σ键,C原子没有孤电子对、形成4个σ键,杂化轨道数目为4;
(5) Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,据此计算Fe(CO)5分子含有的σ键数目是10个;与CO互为等电子体的离子,含有2个原子、价电子总数为10,可以用N原子与1个单位负电荷替换O原子,也可以用C原子与2个单位负电荷替换O原子;
(6)计算结构单元中原子总质量、晶胞体积,利用ρ=![]() 计算晶体密度。
计算晶体密度。
(1)从外观无法区分三者,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无X-射线衍射现象即可确定;
(2) 29号元素Cu元素的基态原子核外电子排布式为1s22s22p63s23p63d104s1;
(3)在Cu2O中Cu+原子的核外电子排布为1s22s22p63s23p63d10,处于d轨道的全满的稳定状态,而若再失去1个电子变为Cu2+时1s22s22p63s23p63d9,是不稳定的状态,CuO在高温时分解为O2和Cu2O;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个;
(4) Cu2+与乙二胺(H2N-CH2-CH2-NH2)中N原子形成配位键;在配位体H2N-CH2-CH2-NH2中C原子与C原子之间形成非极性键;不同元素的原子之间形成极性键,所以该配离子中存在的化学键类型为配位键、极性键、非极性键,故合理选项是ABD;
(5) Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,故Fe(CO)5分子含有10个 σ键,1mol Fe(CO)5分子中含10molσ键,与CO互为等电子体的离子,含有2个原子、价电子总数为10,可以用N原子与1个单位负电荷替换O原子,也可以用C原子与2个单位负电荷替换O原子,与CO互为等电子体的离子为:CN-、C22-等;
(6)图中结构单元底面为正六边形,边长为a nm,底面面积为6×![]() ×a×10-7 cm×a×10-7 cm×sin60°=
×a×10-7 cm×a×10-7 cm×sin60°=![]() cm2;结构单元的体积V=
cm2;结构单元的体积V=![]() cm2×c×10-7 cm=
cm2×c×10-7 cm=![]() cm3,结构单元中含有N原子数为2,含有的Fe原子数为:
cm3,结构单元中含有N原子数为2,含有的Fe原子数为:![]() =6,该晶胞在原子总质量m=
=6,该晶胞在原子总质量m=![]() g,所以该晶体密度ρ=
g,所以该晶体密度ρ=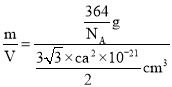 =
=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯结构简式为______________________。
(2)![]() 名称为___________________________。
名称为___________________________。
(3)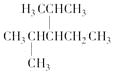 名称为___________________________________。
名称为___________________________________。
(4)![]() 名称为___________________________。
名称为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH变化曲线如图所示。下列有关说法正确的是 ( )
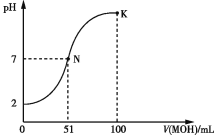
A.HA的电离方程式:HA![]() H++A-
H++A-
B.N点、K点水的电离程度:N<K
C.N点溶液中:c(A-)=c(M+)=c(H+)=c(OH-)
D.K点溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
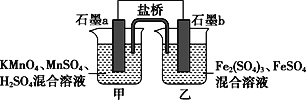
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,下列判断中正确的是
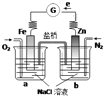
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯b中发生反应为Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
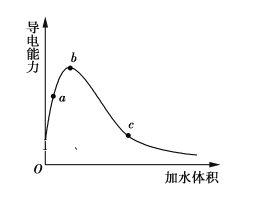
A.a、b、c三点溶液的pH:c<a<b
B.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com