
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
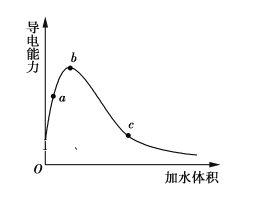
A.a、b、c三点溶液的pH:c<a<b
B.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b
【答案】B
【解析】
A. 导电能力越强,离子浓度越大,H+浓度越大,pH越小;
B. a处溶液稀释时,溶液酸性增强;
C. 随水的增多,醋酸的电离程度在增大;
D. a、b、c三点溶液浓度不同,但溶质的物质的量相同。
A. 导电能力越强,离子浓度越大,H+浓度越大,pH越小,因此a、b、c三点溶液的pH大小关系为:b<a<c,A项错误;
B. 用湿润的pH试纸测量酸性的pH,a处溶液稀释,导电能力增大,溶液酸性增强,pH减小,因此测量结果偏小,B项正确;
C. 随水的增多,醋酸的电离程度在增大,因此a、b、c三点CH3COOH的电离程度:a<b<c,C项错误;
D. a、b、c三点溶液浓度不同,但溶质的物质的量相同,因此用1 mol·L1 NaOH溶液中和,消耗NaOH溶液体积:a=b=c,D项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
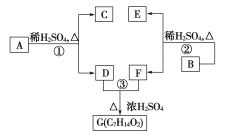
(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,C苯环上的一溴代物只有两种,则C的结构简式为____________________________________________________;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D的分子式为______________,D具有的官能团是________________;
(3)反应①的化学方程式是____________________________________;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②,化合物B能生成E和F,F可能的结构简式是_________________________________________;
(5)E可能的结构简式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
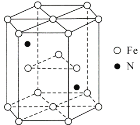
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有______(填字母序号)。
,该配离子中含有的化学键类型有______(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是__(填化学式,写一种)。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),
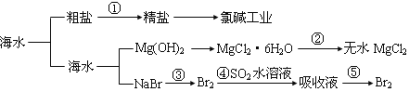
下列有关说法正确的是 ( )
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上金属钠是通过氯碱工业制取
C.在第③④⑤步中溴元素均被氧化
D.从第③步到第⑤步的目的是为了浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
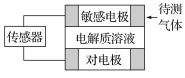
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同
查看答案和解析>>
科目:高中化学 来源: 题型:
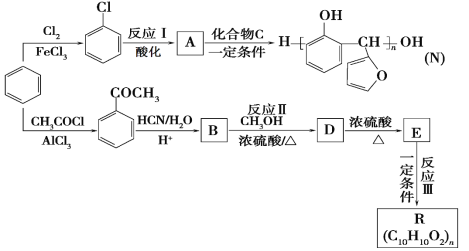
【题目】以苯为主要原料,制取高分子材料N和R的流程如下:
已知: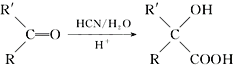
(1)B中含氧官能团的名称是_____________。
(2)由![]() 生成
生成![]() 的反应类型是_____________。
的反应类型是_____________。
(3)一定条件下,发生反应Ⅰ所需的其他反应试剂是_____________。
(4)化合物C的结构简式是_____________。
(5)反应Ⅲ的化学反应方程式是_____________。
(6)下列说法正确的是_____________。(填字母)。
a.A可与NaOH溶液反应 b.常温下,A能和水以任意比混溶
c.化合物C可使酸性高锰酸钾溶液褪色 d.E存在顺反异构体
(7)符合下列条件的B的同分异构体有____________种。
a.能与饱和溴水反应生成白色沉淀
b.属于酯类
c.苯环上只有两个对位取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气______________L(标准状况下)。导线中通过________ mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向密闭容器中充入等物质的量的NO和CO,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。当上述化学反应达到平衡时,下列叙述正确的是( )
N2(g)+2CO2(g)。当上述化学反应达到平衡时,下列叙述正确的是( )
A.CO2和CO的物质的量一定相等
B.NO和CO2的物质的量一定相等
C.反应物的转化率达到了该条件下的最大限度
D.平衡时混合物的总物质的量一定等于反应开始前混合物的总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com