
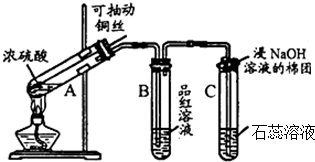
分析 (1)二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫漂白性具有不稳定性,据此解答;
(2)酸性氧化物与水反应生成对应酸,酸能够使石蕊变红色;
(3)A中浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水;
C试管口二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水.
解答 解:(1)浓硫酸与铜反应生成二氧化硫,二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫漂白性具有不稳定性,所以若将该试管B中反应后的溶液加热,可以观察到试管B中的实验现象是:溶液恢复颜色;
故答案为:品红溶液褪色;溶液恢复颜色;
(2)二氧化硫与水反应生成亚硫酸,亚硫酸具有酸性,能够使石蕊变红色,可证明二氧化硫为酸性氧化物;
故答案为:酸性;
(3)A中浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
C试管口二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水,离子方程式:SO2+2OH-=SO32-+H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2OH-=SO32-+H2O.
点评 本题考查了铜与浓硫酸反应的实验及产物验证,明确反应实质及产物的性质是解题关键,注意二氧化硫漂白性特点及酸性氧化物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 已知ag乙烯气体充分燃烧时生成1molCO2和液态水,放出bkJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量数值小于270kJ | |
| C. | 常温常压下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0kJ•mol-1 则C(s,金刚石)═C(s,石墨)△H=-1.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
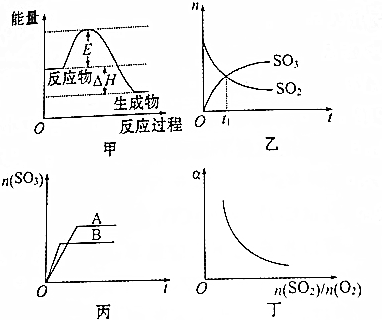
| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.15mol | C. | 0.1mol | D. | 0.075mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
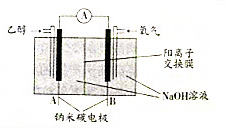
| A. | A极为电池负极,B极为电池正极 | |
| B. | B极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该乙醇燃料电池的总反应方程式为:C2H5OH+3O2═2CO2+3H2O | |
| D. | 当电池消耗4.6g乙醇时,经过阴离子交换膜的OH-为1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、CO32- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Na+、K+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去 KCl中的K2CO3可先加入过量的BaCl2溶液,待沉淀完全后再过滤、洗涤,取滤液蒸发即得纯净的KCl | |
| B. | 氯化钠的溶解度随着温度下降而减少,用冷却结晶法从热的含有少量氯化钾浓溶液中可得到纯净的氯化钠 | |
| C. | 除去Cu粉中混有的少量Fe粉可加入过量的稀盐酸,待无气泡产生后过滤烘干即可 | |
| D. | 通过点燃可除去二氧化碳中混有的CO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com