
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2++2OH-+2HCO =BaCO3↓+CO32-+2H2O
=BaCO3↓+CO32-+2H2O
B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C.向亚硫酸钠溶液中加入足量硝酸:SO +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
D.铜溶解于氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应的元素。
 |
请回答下列问题:
(1)表中属于d区元素的是 (填编号)。
(2)写出基态⑨原子的电子排布式 。
(3)元素⑦形成的RO32- 含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(4)元素①的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,①原子采用sp2杂化
(5)元素⑦(用X表示)的氢化物和元素③(用Y表示)的一种氢化物的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2X | 187 | 202 | 2.6 |
| H2Y2 | 272 | 423 | 以任意比互溶 |
H2X和H2Y2相对分子质量基本相同,造成上述物理性质差异的主要原因
、 。
 (6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
(6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含碘元素,有人设计如下步骤来提取碘:①加入6%H2O2溶液 ②将海带烧成
灰,向灰中加入蒸馏水 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液 ⑥加热煮沸
1~2分钟,合理的操作顺序为
A.②一⑥一④一①一③一⑤ B.②一①一⑥一③一④一⑤
C.②一①一③一⑥一⑤一④ D.②一③一①一⑥一⑤一④
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。
然后再将NaHCO3制成Na2CO3。Ks5u
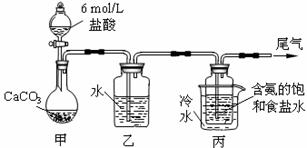 |
⑴ 装置乙的作用是 。为防止污染空
气,尾气中含有的 需要进行吸收处理。
⑵由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、
、 。NaHCO3转化为Na2CO3的化学方程式为 。
⑶若在⑵中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min
的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴
加稀盐酸,并不断搅拌。随着盐酸的加
入,溶液中有关离子的物质的量的变化
如右图所示。
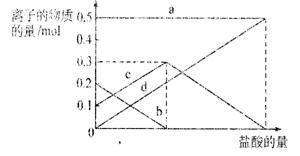
则曲线c对应的溶液中的离子是
(填离子符号);该样品中NaHCO3和
Na2CO3的物质的量之比是 。
⑷若取21.0 g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中
则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,能在强酸溶液中大量共存,并且溶液呈无色的是
A.Na+、Ca2+、Cl-、HCO3- B.K+、Na+、NO3-、MnO4-
C.Mg2+、Na+、SO42-、Cl- D.NH4+、Al 3+、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,溴主要以Br-形式存在于海水中,海水呈弱碱性。回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,该过程的离子方程式为 ,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)需要使用溴时,用硫酸酸化得到的Br-和BrO3-的混合物,而不用盐酸酸化混合物的原因可能是 。
(3)Cl2通入冷的石灰乳,用于制漂白粉,反应的化学方程式为
。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.氯气溶于水: Cl2+ H2O ===2H+ + Cl—+ ClO—
B.氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O ===AlO2- + 4NH4+ + 2H2O
C.过量二氧化硫通入氢氧化钠溶液中:SO2 + OH- ===SO32- + H2O
D.氢氧化铝与足量盐酸反应,Al(OH)3 + 3H+ === Al3+ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要配制1.84 mol·L-1的稀硫酸500mL,回答下列问题:
(1)需要98%密度为1.84 g·cm-3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②50 mL量筒 ③100 mL量筒 ④1000 mL容量瓶 ⑤500 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)下列操作的顺序是(用字母表示) 。
A. 冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有 (填序号)。
A. 配制一定体积准确浓度的标准溶液 B. 长期贮存溶液
C. 用来加热溶解固体溶质 D. 作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
① 用量筒量取浓硫酸时,仰视读数
② 转移后,没有洗涤烧杯和玻璃棒
③ 定容时,俯视读数
④ 定容时,添加蒸馏水超过刻度线后,吸出多余的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.有些物质是由原子直接构成,如金刚石、水晶等;有些物质是由分子直接构成,如干冰、氯化铵等;有些物质是由离子直接构成的,如食盐、烧碱等
B.BF3、H2O、SiCl4、PCl5四种分子中所有原子都满足最外层为8电子结构
C.非金属氧化物不都是酸性氧化物;碱性氧化物都是金属氧化物
D.硫单质的熔点比钠单质的熔点高,这是由于前者比后者有更大的范德华力所致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com