
 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。
然后再将NaHCO3制成Na2CO3。Ks5u
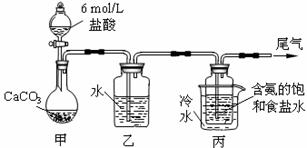 |
⑴ 装置乙的作用是 。为防止污染空
气,尾气中含有的 需要进行吸收处理。
⑵由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、
、 。NaHCO3转化为Na2CO3的化学方程式为 。
⑶若在⑵中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min
的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴
加稀盐酸,并不断搅拌。随着盐酸的加
入,溶液中有关离子的物质的量的变化
如右图所示。
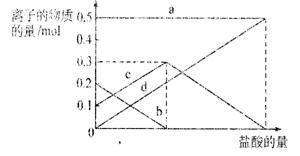
则曲线c对应的溶液中的离子是
(填离子符号);该样品中NaHCO3和
Na2CO3的物质的量之比是 。
⑷若取21.0 g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中
则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)。
科目:高中化学 来源: 题型:
向100ml 1mol/L 的Al2(SO4)3 溶液中加入100ml NaOH溶液,得到7.8克白色沉淀,请问NaOH溶液物质的量浓度可能是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a ▲ 0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)= ▲ mol·L-1,c(CH3COOH)= ▲ mol·L-1;
(3)CH3COOH的电离平衡常数Ka= ▲ (用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是 ▲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④Na2O2投入FeCl3溶液
A.①④ B.②③④ C.②③ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为:
A.3︰14 B.1︰7 C.2︰7 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A.氧化铁、硫酸铜、硫酸 B.氢氟酸、空气、纯碱
C.硝酸、胆矾、熟石灰 D.醋酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2++2OH-+2HCO =BaCO3↓+CO32-+2H2O
=BaCO3↓+CO32-+2H2O
B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C.向亚硫酸钠溶液中加入足量硝酸:SO +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
D.铜溶解于氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,开始时,夹子处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列中的( )
A.氢氧化钠溶液、二氧化硫
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮


查看答案和解析>>
科目:高中化学 来源: 题型:
图表法、图象法是常用的科学研究方法。阅读下列图表回答问题:

(1)图A是第三周期某主族元素M的电离能变化情况的图像。则M元素位于周期表的 族,根据同周期元素第一电离能的变化规律,推断在M元素所在周期的所有元素中,M元素的第一电离能的大小(最小)范围为 <M< (填元素符号)。
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图像,其中表示I2的曲线的是 (填“a”、“b”、“c”),理由是 。
(3) 图C是1~18号元素中部分连号元素单质的熔点变化情况图,其中c点代表的单质是__________,其熔点高的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com