
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。

则下列说法正确的是( )
A.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B.G的同分异构体中属于酯且能发生银镜反应的只有一种
C.上述各物质中能发生水解反应的有A、B、D、G
D.A的结构简式为
【答案】D
【解析】
试题分析:A、A的不饱和度=![]() =5,B能和二氧化碳反应生成D,D能和溴水发生取代反应生成白色沉淀,说明D中含有酚羟基,所以A中含有苯环,因为A的不饱和度是5,则A中含有一个不饱和键;A能和氢氧化钠的水溶液发生水解反应生成B和C,则A中含有酯基,C酸化后生成E,E是羧酸,E和乙醇发生酯化反应生成G,G的分子式为C4H8O2,根据原子守恒知,E的分子式为C2H4O2,则E的结构简式为CH3COOH,C为CH3COONa,G的结构简式为CH3COOCH2CH3,根据原子守恒知,D的分子式为C6H6O,则D结构简式为:
=5,B能和二氧化碳反应生成D,D能和溴水发生取代反应生成白色沉淀,说明D中含有酚羟基,所以A中含有苯环,因为A的不饱和度是5,则A中含有一个不饱和键;A能和氢氧化钠的水溶液发生水解反应生成B和C,则A中含有酯基,C酸化后生成E,E是羧酸,E和乙醇发生酯化反应生成G,G的分子式为C4H8O2,根据原子守恒知,E的分子式为C2H4O2,则E的结构简式为CH3COOH,C为CH3COONa,G的结构简式为CH3COOCH2CH3,根据原子守恒知,D的分子式为C6H6O,则D结构简式为:![]() ,B为
,B为![]() ,F为
,F为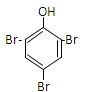 ,则A的结构简式为:
,则A的结构简式为:![]() ,则A不正确;B、G的同分异构体中属于酯且能发生银镜反应的应该是甲酸形成的酯类,则相应的醇是丙醇,丙醇有2种,B不正确;C、上述各物质中能发生水解反应的有A、B、C、D、G,C不正确;D、A的结构简式为
,则A不正确;B、G的同分异构体中属于酯且能发生银镜反应的应该是甲酸形成的酯类,则相应的醇是丙醇,丙醇有2种,B不正确;C、上述各物质中能发生水解反应的有A、B、C、D、G,C不正确;D、A的结构简式为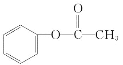 ,D正确,答案选D。
,D正确,答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I、二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2![]() 2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:
2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:

①300℃时,平衡常数K=________,升高温度,K值______(填“增大”、“减小”或“不变”)。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)=______________。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是________。
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
④已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
II、如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。

III、现有反应:mA(g)+nB(g)![]() pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)若加入B(体积不变),则A的转化率______。
(2)若升高温度,则平衡时B、C的浓度之比![]() 将________。
将________。
(3)若加入催化剂,平衡时气体混合物的总物质的量__________。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________,
而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、“变浅”或“不变”)。
(5)在固定容积的密闭容器中能说明反应己达平衡状态的是______________。
A.浓度pc(B)=nc(C) B.容器内压强保持不变
C.pv逆(B)=n v正(C) D.容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
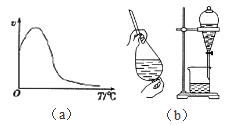
A. 溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜
B. 仅用新制的氢氧化铜悬浊液一种试剂可鉴别乙醇、乙酸、乙酸乙酯、葡萄糖溶液(必要时可加热)
C. 过氧化氢在酶作用下的分解反应速率随温度的变化关系如图(a)所示
D. 在实验中从溴水中分离出溴,先加入少量CCl4, 可选用的操作、装置如图(b)所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
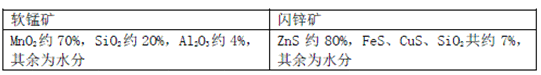
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
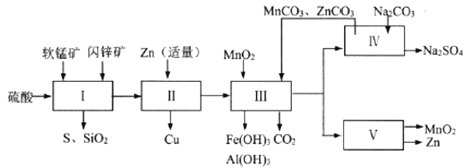
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
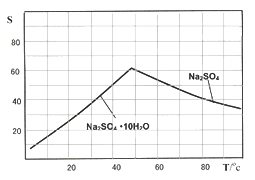
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是
A. 镁和铁 B. 钠和铁 C. 锌和锅 D. 锌和铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是

A.始祖鸟烯与乙烯互为同系物
B.若Rl=R2= —CH3,则其化学式为C12H16
C.若R1=R2,烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种
D.始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业制取Na2SO3固体的过程如下:

已知:① 反应I在三颈烧瓶中发生,装置如图甲所示(固定及加热类仪器省略)。
② 部分物质的溶解度曲线如图乙所示,其中Na2SO3饱和溶液低于50℃时析出Na2SO3·7H2O。
(l)反应I的目的是制取(NH4)2SO3溶液。

① 反应I的离子方程式为____________。
② 亚硫酸分解产生的SO2须冷却后再通入氨水中,目的是____________。
③ 下列关于图甲装置或操作的叙述正确的是______(填字母)。
A.接入冷凝管的冷却水从a端通入
B.长玻璃导管具有防倒吸的作用
C. 控制加热亚硫酸的温度,可以控制生成SO2气体的速率
(2)为获取更多的Na2SO3固体,要将反应II的温度控制在80℃左右,并_______(填操作I的名称)。
(3)由滤液可以制取NH4Cl固体。
①验证滤液中含有NH4+的实验操作是________。
②由滤液可获得NH4Cl粗产品(含少量Na2SO3)。请补充完整由NH4Cl粗产品制取纯净的NH4Cl固体的实验方案:________,得到纯净的NH4Cl固体。(实验中须使用的试剂有SO2、乙醇,除常用仪器外须使用的仪器有:真空干燥箱)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com