
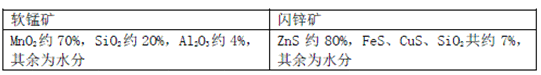
【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
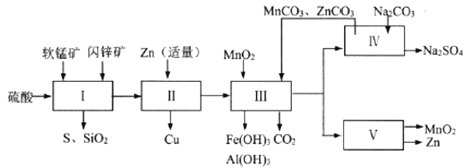
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
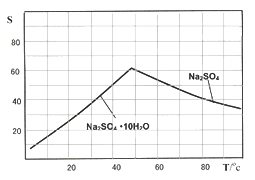
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。
【答案】 3 Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+ 当Fe2+完全沉淀时碱过量,得不到Al(OH)3沉淀 调节溶液的pH,使Fe3+和Al3+生成沉淀 洗涤 尽量减少Na2SO4的溶解量 Na2CO3 Mn2+-2e-+2H2O=MnO2+4H+ 1.025
【解析】依据流程图分析可知,流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫和二氧化硅,滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,过滤得到铜。流程Ⅲ中,加入MnO2将亚铁离子氧化成铁离子同时消耗酸而得到氢氧化铁和氢氧化铝沉淀,滤液中含有硫酸锰和硫酸锌,流程Ⅳ为滤液中加入碳酸钠得碳酸锰、碳酸锌可循环利用,滤液为硫酸钠溶液,流程Ⅴ为电解硫酸锰和硫酸锌混合溶液可得二氧化锰和锌,则(1)流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫和二氧化硅,滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,其中FeS、CuS、ZnS中硫元素及铁元素化合价都升高,所以被氧化的物质有三种;(2)流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,反应的离子方程式为Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+;(3)①图表数据可知,亚铁离子沉淀完全的pH为7.6,而铁离子沉淀完全的pH为1.5,要将亚铁离子完全沉淀,碱需要过量,此时生成的氢氧化铝会溶解,因此必须把亚铁离子氧化成铁离子,使铁元素能全部沉淀;②要测定铁离子和铝离子,需要调节pH,又因为不能引入新杂志,所以MnCO3和ZnCO3的作用是调节溶液的pH,使Fe3+和Al3+生成沉淀;(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤,尽量减少Na2SO4的溶解量;洗涤晶体时用乙醇洗涤避免形成结晶水合物;(5)由于碳酸钠在反应中被消耗,且在后续反应中不能产生,因此还需要购买的原料是碳酸钠;(6)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极锰离子失电子生成,电极反应为Mn2+-2e-+2H2O=MnO2+4H+;(7)据反应MnSO4+ZnSO4+2H2O=MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得0.7x/87:0.8y/97=1:1,故x:y=1.025.


科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法错误的是( )
A. 氨气可用于制造氮肥B. 浓硫酸可用于干燥氨气
C. 氯气可用于制漂白粉D. 食醋可用于除水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知RxO42- + MnO4- + H+ → RO2 + Mn2+ + H2O,变化过程中,有0.2molRxO42- 参加反应时,共转移0.4mol电子。则RxO42- 中的x为
A. 1 B. 2 C. 3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前电解法制烧碱通常采用离子交换膜法,阳(阴)离子交换膜不允许阴(阳)离子通过。则下列叙述中错误的是( )

A. NaOH、H2均在Ⅰ区产生
B. 图中a为阴离子交换膜
C. 使用离子交换膜可以有效地隔离NaOH和Cl2,阻止二者之间的反应
D. 电解时往Ⅲ区的溶液中滴加几滴甲基橙,溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。

则下列说法正确的是( )
A.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B.G的同分异构体中属于酯且能发生银镜反应的只有一种
C.上述各物质中能发生水解反应的有A、B、D、G
D.A的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 己知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol,则H2的标准燃烧热为-241.8 kJ/mol
B. 已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热置,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D. 已知 2SO2(g)+O2(g) ![]() 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2X(g) ![]() Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
化情况如下表:

下列说法不正确的是( )
A. c>1.0 B. 实验2可能使用了催化剂
C. 实验3比实验2先达到化学平衡状态 D. 前10分钟,实验4的平均化学反应速率比实验1的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH在5.6~7.0之间的雨水通常称为酸雨
B. 新制氯水经光照一段时间后,pH增大
C. 燃煤时加入适量石灰石,可减少废气中SO2的含量
D. 测定某溶液pH时,应先用蒸馏水润湿pH试纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com