
【题目】下列说法正确的是( )
A.熔点:锂<钠<钾<铷<铯
B.由于HCl的分子间作用力比HI的强,故HC1比HI稳定
C.等质量的金刚石和石墨晶体所含碳碳键的数目相等
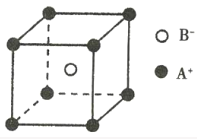
D.已知离子晶体AB的晶胞如图所示,则每个A+周围距离最近且等距的B-有8个
【答案】D
【解析】
A. 金属键越强其单质的熔点越高,金属键:锂>钠>钾>铷>铯,则物质的熔点:锂>钠>钾>铷>铯,A错误;
B. HCl比HI稳定是因为分子内的化学键H-Cl键比H-I键强,断裂消耗的能量高,与分子之间的作用力大小无关,B错误;
C. 金刚石是立体网状结构,每个C原子与相邻的四个C原子形成四个共价键,每个共价键为2个C原子形成,所以属于1个C原子的C-C键数目为4×![]() =2,12 g金刚石中含C原子的物质的量是1 mol,则其中含有2 mol C-C键,石墨是层状结构,每个C原子与相邻的3个C原子形成3个共价键,每个共价键为2个C原子形成,所以属于1个C原子的C-C键数目为3×
=2,12 g金刚石中含C原子的物质的量是1 mol,则其中含有2 mol C-C键,石墨是层状结构,每个C原子与相邻的3个C原子形成3个共价键,每个共价键为2个C原子形成,所以属于1个C原子的C-C键数目为3×![]() =1.5,12 g石墨中含有1.5 mol C-C键,可见等质量的金刚石和石墨晶体所含碳碳键的数目不相等,C错误;
=1.5,12 g石墨中含有1.5 mol C-C键,可见等质量的金刚石和石墨晶体所含碳碳键的数目不相等,C错误;
D. A+位于晶胞的顶点上,B-位于晶胞内,通过一个顶点可形成8个晶胞,所以每个A+被8个B-所形成的立方体包围,B-亦被8个A+所形成的立方体包围,每个A+周围距离最近且等距的B-有8个, 每个B-周围距离最近且等距的A+有8个,D正确;
故合理选项是D。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】以铁作阳极,利用电解原理可使废水中的污染物凝聚而分离,其工作原理如图所示。下列说法错误的是( )
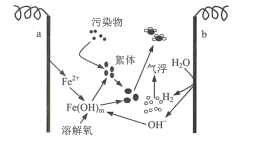
A.电极b为阴极
B.a极的电极反应式:Fe-2e-=Fe2+
C.处理废水时,溶液中可能发生反应:4Fe2++O2+8OH-+2H2O=4Fe(OH)3
D.电路中每转移3 mol电子,生成1 mol Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)![]() 3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
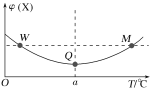
A.M点时,Y的转化率最大
B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小
D.W、M两点Y的正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
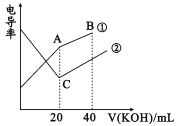
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
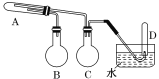
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________、中心原子的杂化形式为________。LiAlH4中,存在_________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
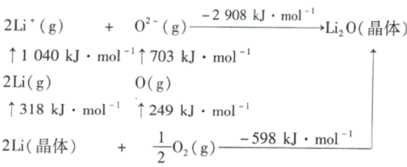
可知,Li原子的第一电离能为_________kJ·mol-1,O=O键键能为__________ kJ·mol-1,Li2O晶格能为_________ kJ·mol-1
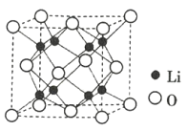
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加德罗常数的值为NA,则Li2O的密度为___________g·cm-3(列出计算式)。
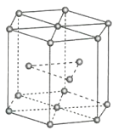
(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为______ g·cm-3(列出计算式)。
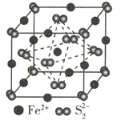
(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是______________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________。
GeCl4 | GeBr4 | Gel4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__________,微粒之间存在的作用力是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C(
);C(![]() ,0,
,0,![]() ),则D原子的坐标参数为_________。
),则D原子的坐标参数为_________。
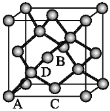
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如右图所示。
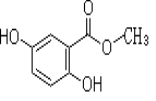
回答以下问题:
(1)龙胆酸甲酯所含官能团名称为 _________________
(2)龙胆酸甲酯的分子式为________________
(3)下列有关龙胆酸甲酯的描述,正确的是______________(填字母)。
a.能发生消去反应
b.能与氢气发生加成反应
c.能与浓溴水反应
(4)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式___________________ 。
(5)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_________、____________。
① 能发生银镜反应; ② 能使FeCl3溶液显色;
③ 酯类 ④苯环上的一氯代物只有两种
(6)已知X及其它几种有机物存在如下转化关系,且测得C4H8含有一个支链,A的核磁共振氢谱图中有两个吸收峰。
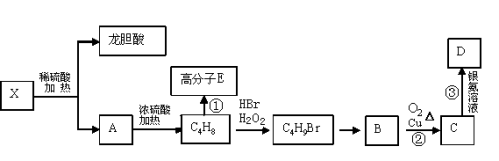
写出①的化学方程式____________________________________。
②的化学方程式______________________________________。
③化学方程式 ________________________________________。
写出X的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com