
| A. | CO2、SO2、NH3都是直线形分子 | |
| B. | CO2、NH3、H2S 的键角依次减小 | |
| C. | H2O2、N2H4分子的中心原子都是 sp3杂化 | |
| D. | C、N、F元素的电负性依次增大 |
分析 A.如果分子中中心原子价层电子对个数是2且不含孤电子对,则该分子为直线形分子,如果分子中中心原子价层电子对个数是3且含有一个孤电子对,则为V形分子,如果分子中中心原子价层电子对个数是4且含有一个孤电子对,则为三角锥形分子;
B.二氧化碳是直线形分子、氨气分子为三角锥形分子、硫化氢为V形分子,且孤电子对之间的排斥力大于孤电子对和成键电子对之间的排斥力;
C.先计算中心原子价层电子对个数,再根据价层电子对互斥理论判断原子杂化方式;
D.同一周期元素,元素电负性随着原子序数增大而增大.
解答 解:A.CO2分子中C原子价层电子对个数是2且不含孤电子对,为直线形分子,SO2分子中S原子价层电子对个数是3且含有一个孤电子对,为V形分子,NH3分子中N原子价层电子对个数是4且含有一个孤电子对,所以为三角锥形,故A错误;
B.二氧化碳是直线形分子、氨气分子为三角锥形分子且含有1个孤电子对、硫化氢为V形分子且含有2个孤电子对,且孤电子对之间的排斥力大于孤电子对和成键电子对之间的排斥力,所以CO2、NH3、H2S 的键角依次减小,故B正确;
C.H2O2分子中O原子价层电子对个数是4、N2H4分子中N原子价层电子对个数是4,根据价层电子对互斥理论知,O、N原子都采用sp3杂化,故C正确;
D.同一周期元素,元素电负性随着原子序数增大而增大,所以C、N、F元素的电负性依次增大,故D正确;
故选A.
点评 本题考查元素周期律、原子杂化方式判断、微粒空间构型判断等知识点,侧重考查学生知识综合运用能力,明确价层电子对互斥理论内涵及元素周期律是解本题关键,注意孤电子对的计算方法,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Z、W、X | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
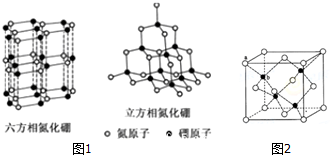
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
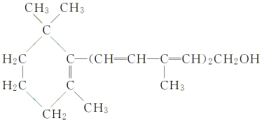
| A. | 维生素A是一种易溶于水的醇 | |
| B. | 维生素A的一个分子中含有5个碳碳双键 | |
| C. | 维生素A具有环己烷的结构单元 | |
| D. | 维生素A能发生加成、氧化、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
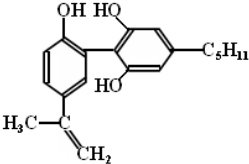
| A. | 该分子中所有碳原子一定都在一个平面上 | |
| B. | 该分子遇FeCl3溶液显紫色,但与苯酚不属于同系物 | |
| C. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com