
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子,有人设计了图中的工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜(图中标号处只利用工业生产中的常用的酸、碱和废铁屑). 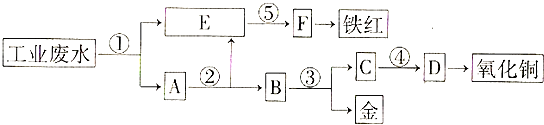
(1)图中标号处需加入的相应物质分别是①、②、③、④、⑤;
(2)写出①处所有可能发生的离子方程式
(3)写出③处发生反应的化学方程式;
(4)铁红的化学式为;写出铁红在工业上的一种主要用途 .
【答案】
(1)铁屑|稀硫酸|稀硝酸|氢氧化钠|氢氧化钠
(2)Fe+2H+═Fe2++H2↑;2Fe3++Fe═3Fe2+;Cu2++Fe═Cu+Fe2+;2Au3++3Fe═2Au+3Fe2+
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(4)Fe2O3|红色涂料
【解析】解:由工艺流程图示知,E为铁元素的离子,而A为铜、金的单质,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,因此①处加入的物质为铁屑,发生的反应为Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;②处加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的硫酸亚铁溶液与含Fe2+的E溶液相混合;③处利用金不溶于硝酸的性质将铜与金分离开;④处将得到的铜离子用氢氧化钠转化为氢氧化铜沉淀,从而再受热分解为氧化铜;⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红(氧化铁).(1)由以上分析可知①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠,
所以答案是:铁屑;稀硫酸;稀硝酸;氢氧化钠;氢氧化钠;(2)①处加入的物质为铁屑,发生的反应为Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;
所以答案是:Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;(3)③处利用金不溶于硝酸的性质将铜与金分离开,反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
所以答案是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;(4)⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红,常用作红色涂料,氧化铜常用作制造铜盐的原料.
所以答案是:Fe2O3;用作红色涂料.


科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol/LFeCl3溶液 |
(1)实验①和②的目的是_________________________________。实验时由于没有观察到明显现象而无法得出结论。为了达到实验目的,你对原实验方案的改进措施是______________________________________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图所示。
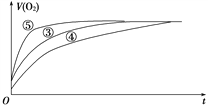
分析上图能够得出的实验结论是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,不会发生明显颜色变化的是
A. 氯化铜固体溶于水中 B. 硫酸铁溶液中滴加硫氰酸钾溶液
C. 氯化亚铁溶液中加入铜粉 D. 硫酸亚铁溶液中通入氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胶体在电泳时,它的胶粒向阳极移动。在这胶体中分别加入下列物质:①乙醇溶液、②氯化钠溶液、③土壤、④氢氧化铁胶体,不会发生聚沉的是
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000~10000 mg·L-1。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。本品须密封,置阴凉暗处保存。请完成以下填空:
(1)推测该消毒液的酸碱性: ,
原因是(用离子方程式表示)。
(2)该消毒液还具有的化学性质是性和性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氯气的叙述中,不正确的是
A. 氯气可使湿润的红布条退色,所以氯气具有漂白性
B. 氯气可以使湿润的蓝色石蕊试纸先变红后褪色
C. 铜在氯气燃烧产生棕黄色的烟
D. 氯气是黄绿色的,氯离子是无色的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO45H2O)及副产物ZnO.制备流程图如下: 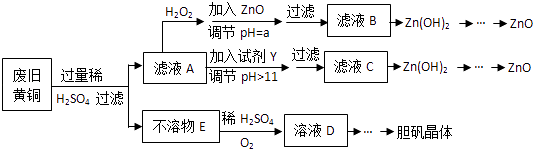
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 , a的范围是 .
(2)由不溶物E生成溶液D的化学方程式为 .
(3)滤液A中加入H2O2反应的离子方程式为 .
(4)由溶液D制胆矾晶体包含的主要操作步骤是 .
(5)下列试剂可作为Y试剂的是 . A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com