
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
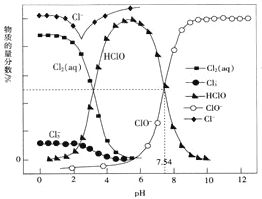
A. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa= -7.54
H++ClO-的电离常数Ka的对值lgKa= -7.54
B. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
C. pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
D. 已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3-(aq)的K=0.191,当pH增大时,K减小
Cl3-(aq)的K=0.191,当pH增大时,K减小
【答案】D
【解析】
A. 根据图像,pH=7.54时c(HClO)=c(ClO-),由电离方程式HClO![]() ClO-+H+可知, Ka=
ClO-+H+可知, Ka=![]() =c(H+)由此分析解答;
=c(H+)由此分析解答;
B.从氯水中含有的Cl2、ClO-、HClO均具有氧化性,KI具有还原性分析;
C.根据pH=1时溶液中各种微粒的物质的量分数分布分析;
D.根据化学平衡常数只与温度有关分析。
A. 根据图像,pH=7.54时c(HClO)=c(ClO-),由电离方程式HClO![]() ClO-+H+可知,Ka=
ClO-+H+可知,Ka=![]() =c(H+)=10-7.54,则lgKa=-7.54,A正确;
=c(H+)=10-7.54,则lgKa=-7.54,A正确;
B.氯水中含有的Cl2、ClO-、HClO均具有氧化性,KI具有还原性,Cl2、ClO-、HClO三种微粒都可以与KI发生氧化还原反应,B正确;
C.根据图像,pH=1时氯水中各种含氯微粒的物质的量分数由多到少的顺序是:Cl->Cl2>Cl3->HClO>ClO-,由于溶液为同一溶液,溶液的体积相同,所以溶液中微粒的浓度大小关系为:c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-),C正确;
D.已知常温下反应Cl2(aq)+Cl-(aq) ![]() Cl3-(aq)的K=0.191,K只与温度有关,温度不变,pH增大时,K不变,D错误;
Cl3-(aq)的K=0.191,K只与温度有关,温度不变,pH增大时,K不变,D错误;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
(1)理论上需要多少克MnO2参加反应?_____________
(2)参加反应的HCl的物质的量为多少?_____________
(3)被氧化的HCl的物质的量为多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As和P属于同主族元素,它们都能形成多种含氧酸。中国自古就有“信口雌黄”“雄黄入药”之说。雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。在一定条件下,雌黄和雄黄的转化关系如图所示。

(1)亚磷酸(H3PO3)是一种精细化工产品。亚磷酸(H3PO3)与足量NaOH溶液反应生成Na2HPO3。
①则亚磷酸为___(填“一”“二”或“三”)元酸。
②查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7,Na2HPO3可使碘水褪色,25℃时,Na2HPO3水解反应的Kh=____,若向Na2HPO3溶液中加入少量的I2,则溶液中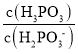 将__(填“增大”、“减小”或“不变”)
将__(填“增大”、“减小”或“不变”)
(2)反应II中,若0.5molAs4S4参加反应,转移14 mol电子,则物质a为__(填化学式)
(3)反应Ⅲ中的产物亚砷酸H3AsO3可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
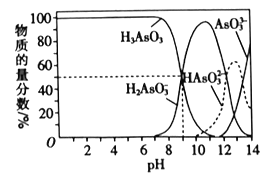
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20g质量分数为14%的KNO3溶液与30g质量分数为24%的KNO3溶液混合,得到的密度为1.26 g/mL的混合溶液。计算:
(1)混合后溶液的质量分数_______________________。
(2)混合后溶液的物质的量浓度________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):Cu+2H2SO4![]() CuSO4+A↑+2H2O,试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O,试通过计算和推理完成下面的问题:
(1)在参加反应的硫酸中,被还原的硫酸与未被还原的硫酸的物质的量之比为___。A物质可以与强碱反应生成盐和水。则A应该属于___(用字母代号填写)。
A.酸 B.酸性氧化物 C.盐 D.电解质 E.非电解质
(2)一定量的铜片与含1.2mol的H2SO4的浓硫酸充分反应(浓硫酸过量),如果该反应过程中转移了0.4mol电子,生成的A气体在标况下的体积为___L(假设气体全部逸出)。
(3)将(2)中反应后所得的溶液稀释后与足量的Ba(OH)2溶液反应,所得沉淀的质量为___g。写出此过程中发生反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X) =
(X) =![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A. pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH-)
B. 常温下,H2A的电离平衡常数Ka2=10-42
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. KHA溶液中离子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,反应![]() +H2O
+H2O![]() H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A. 0.2mol·L1氨水:c(NH3·H2O)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 0.2mol·L1NH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() )>c(H2CO3)>c(NH3·H2O)
)>c(H2CO3)>c(NH3·H2O)
C. 0.2mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(![]() )+c(NH3·H2O)=c(H2CO3)+c(
)+c(NH3·H2O)=c(H2CO3)+c(![]() )+c(
)+c(![]() )
)
D. 0.6mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(![]() )+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
)+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com