
【题目】已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):Cu+2H2SO4![]() CuSO4+A↑+2H2O,试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O,试通过计算和推理完成下面的问题:
(1)在参加反应的硫酸中,被还原的硫酸与未被还原的硫酸的物质的量之比为___。A物质可以与强碱反应生成盐和水。则A应该属于___(用字母代号填写)。
A.酸 B.酸性氧化物 C.盐 D.电解质 E.非电解质
(2)一定量的铜片与含1.2mol的H2SO4的浓硫酸充分反应(浓硫酸过量),如果该反应过程中转移了0.4mol电子,生成的A气体在标况下的体积为___L(假设气体全部逸出)。
(3)将(2)中反应后所得的溶液稀释后与足量的Ba(OH)2溶液反应,所得沉淀的质量为___g。写出此过程中发生反应的离子方程式___。
【答案】1:1 BE 4.48L 252.6 Ba2++SO42+2OH- +2H+=2H2O+BaSO4↓、Ba2++ SO42+2OH- +Cu2+=Cu(OH)2↓+BaSO4↓
【解析】
(1)根据电子转移守恒与原子守恒可以知道,A为SO2,被还原的硫酸生成SO2,未被还原的硫酸生成CuSO4,根据方程式可以知道二者物质的量之比;SO2能与强碱反应生成盐和水,则SO2属于酸性氧化物,根据电解质、非电解质的判断方法判断二氧化硫属于哪一类;
(2)根据电子转移计算生成二氧化硫物质的量,再根据V=n×Vm计算二氧化硫体积;
(3)Cu与硫酸反应中生成硫酸铜,因为硫酸有剩余,故反应后溶液为硫酸、硫酸铜混合溶液,硫酸与氢氧化钡反应生成硫酸钡与水,硫酸铜与氢氧化钡反应生成硫酸钡、氢氧化铜,根据S原子守恒计算n(BaSO4),再根据m=nM计算m(BaSO4),根据方程式计算n(CuSO4),再根据m=nM计算m(CuSO4),据此分析。
(1)根据得失电子守恒与原子守恒可以知道,A为SO2,被还原的硫酸生成SO2,未被还原的硫酸生成CuSO4,根据方程式可以知道二者物质的量之比为1:1;SO2能与强碱反应生成盐和水,则SO2属于酸性氧化物,SO2的水溶液虽然可以导电,但是溶液中的离子是亚硫酸电离产生的,则SO2属于非电解质;
故答案为:1:1;BE;
(2)根据电子转移,可以知道生成二氧化硫物质的量为![]() ,标况下二氧化硫体积为0.2mol×22.4L·mol-1=4.48L;
,标况下二氧化硫体积为0.2mol×22.4L·mol-1=4.48L;
故答案为:4.48L;
(3)反应后,所得到的溶液含硫酸铜和硫酸,反应的化学方程式为:Ba(OH)2+H2SO4=BaSO4↓+2H2O、Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓,离子反应方程式为Ba2++SO42+2OH- +2H+=2H2O+BaSO4↓、Ba2++ SO42+2OH- +Cu2+=Cu(OH)2↓+BaSO4↓,反应后产生的沉淀为Cu(OH)2和BaSO4,已知反应开始时n(H2SO4)=1.2mol,生成n(SO2)=0.2mol,根据S原子守恒,可以知道n(BaSO4)=1.2mol-0.2mol=1mol,m(BaSO4)=1mol×233g·mol-1=233g;根据反应方程式可知,n(CuSO4)=0.2mol,则m(Cu(OH)2)=0.2mol×98g·mol-1=19.6g,则反应所得沉淀质量为:233g+19.6g=252.6g;
故答案为:252.6;Ba2++SO42+2OH- +2H+=2H2O+BaSO4↓、Ba2++ SO42+2OH- +Cu2+=Cu(OH)2↓+BaSO4↓。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是

A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中可以利用反应KClO3+6HCl═KCl+3Cl2↑+3H2O来制取氯气。
(1)用双线桥标出该反应中电子转移的方向和数目_____________________KClO3+6HCl(浓)═KCl+3Cl2+3H2O
(2)该反应中还原剂是_____,还原产物是______.
(3)若有1molHCl完全反应,则转移的电子得到物质的量是_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
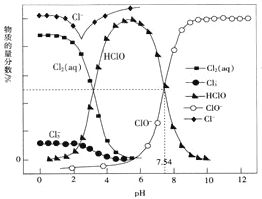
A. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa= -7.54
H++ClO-的电离常数Ka的对值lgKa= -7.54
B. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
C. pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
D. 已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3-(aq)的K=0.191,当pH增大时,K减小
Cl3-(aq)的K=0.191,当pH增大时,K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
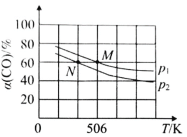
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
![]() +2KMnO4
+2KMnO4![]()
![]() +KOH+
+KOH+
2MnO2↓+H2O
![]() +HCl
+HCl![]()
![]() +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
![]()
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 | |
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, | | 白色晶体 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如图。
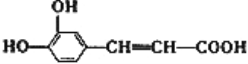
(1)写出咖啡酸中两种含氧官能团的名称:____________。
(2)根据咖啡酸的结构,列举咖啡酸非含氧官能团可以发生的二种反应类型:____________。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制1 mol/L的氢氧化钠溶液250mL,完成下列部分步骤:
①用天平称取氢氧化钠固体__________克。
②将称好的氢氧化钠固体放入小烧杯中加适量蒸馏水将其溶解,待冷却后将溶液沿玻璃棒转移入__________的容量瓶中。
③用少量蒸馏水冲洗玻璃棒及烧杯2~3次,将冲洗液移入容量瓶中。
④向容量瓶内加水至刻度线1~2cm时,改用__________小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com