
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
(1)理论上需要多少克MnO2参加反应?_____________
(2)参加反应的HCl的物质的量为多少?_____________
(3)被氧化的HCl的物质的量为多少?____________
【答案】8.7g 0.4mol 0.2mol
【解析】
反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,化合价升高值=化合价降低值=转移电子数;n(Cl2)=![]() =0.1mol,参加反应的盐酸是被氧化盐酸的物质的量的2倍,结合反应的化学方程式计算。
=0.1mol,参加反应的盐酸是被氧化盐酸的物质的量的2倍,结合反应的化学方程式计算。
(1)n(Cl2)=2.24L÷22.4L·mol-1=0.1mol,
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87g 1mol
m 0.1mol
m=8.7g,
答:理论上需要8.7gMnO2参加反应;
(2)①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4mol 1mol
0.4mol 0.1mol
参加反应的HCl的物质的量为0.4mol;
(3)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 被氧化HCl
MnCl2+Cl2↑+2H2O 被氧化HCl
1mol 2mol
0.1mol 0.2mol,
被氧化的HCl的物质的量为0.2mol。


科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )
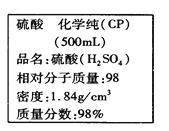
A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
C. 配制250mL 4.6 mol·L-1的稀硫酸需取该硫酸62.5mL
D. 该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示装置是一种可充电电池,装置Ⅱ为电解池.好交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 ![]() Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
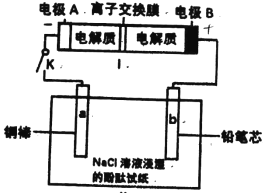
A. 闭合K后,a电极上有气体产生
B. 装置I中电子由B经过交换膜移向A
C. 装置I充电时,电极A的电极反应式:2Na2S2—2e-=Na2S4+2Na+
D. 当有0.01molNa+通过离子交换膜时,b电极上析出标准状况下的气体112mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式
(1)氯气和水反应:_____________________________ ;
(2)Ca(ClO)2+CO2+H2O:___________________________ ;
(3)工业上制取氯气:________________________________ ;
(4)工业制漂白粉:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。
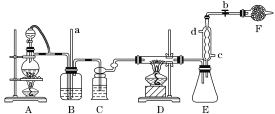
资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)实验时在仪器中加试剂前要先___________________________。
(2)实验中分液漏斗上口玻璃塞连接导管的作用是__________________________________ B装置的作用是_____________________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E装置作用是_______________________。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是

A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是

A. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa= -7.54
H++ClO-的电离常数Ka的对值lgKa= -7.54
B. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
C. pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
D. 已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3-(aq)的K=0.191,当pH增大时,K减小
Cl3-(aq)的K=0.191,当pH增大时,K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
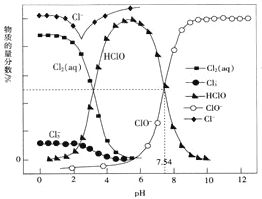
A. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa= -7.54
H++ClO-的电离常数Ka的对值lgKa= -7.54
B. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
C. pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
D. 已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3-(aq)的K=0.191,当pH增大时,K减小
Cl3-(aq)的K=0.191,当pH增大时,K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com