
【题目】如下图所示装置是一种可充电电池,装置Ⅱ为电解池.好交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 ![]() Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
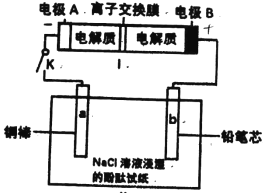
A. 闭合K后,a电极上有气体产生
B. 装置I中电子由B经过交换膜移向A
C. 装置I充电时,电极A的电极反应式:2Na2S2—2e-=Na2S4+2Na+
D. 当有0.01molNa+通过离子交换膜时,b电极上析出标准状况下的气体112mL
【答案】D
【解析】
b极附近先变红色,说明b极溶液呈现碱性。电解饱和食盐水中,阴极H+得到电子,生成OH-,则b极为阴极,电极B为负极,A为正极,a为阳极。
A.a为阳极,Cu为活性电极,Cu失去电子,没有气体产生。A项错误;
B.电子只能在导体中移动,不能在电解液中移动,B项错误;
C.A电极为正极,充电时为阳极,阳极发生氧化反应,NaBr变为NaBr3,C项错误;
D.在闭合回路中,每个截面通过的电量都是一样的,有0.01mol Na+通过离子交换膜,电路中一定有0.01mole-转移。b极产生氢气,转移2mol e-可以生成1mol氢气,体积为22.4L。现通过0.01mole-,则生成0.005mol氢气,在标准状况下其体积为112mL。D项正确;
本题答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组表述中,正确的是
A. 区分晶体和非晶体最可靠的科学方法是对固体进行 X射线衍射
B. 离子键、金属键无方向性和饱和性,而所有共价键都有方向性和饱和性
C. 处于能量最低状态时,外围电子排布为4d15s2的某元素原子,M能层共有8个电子,该元素位于![]() 区第ⅢB族
区第ⅢB族
D. 对充有氖气的霓虹灯管通电,灯管发出红色光.产生这一现象的主要原因是电子由基态向激发态跃迁时以光的形式释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
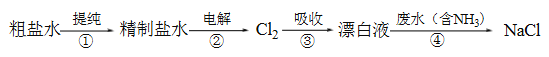
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是____________(用元素符号表示);
(2)X与水反应的化学方程式是______________;
(3)X中一种元素对应的单质,可与石灰乳反应得到漂白粉,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末由Na2O与Na2O2组成,将其分成等量的二份,一份与足量的CO2气体作用,发现该固体质量增加了10.0g,同时生成了新的气体A;另一份溶于过量的盐酸后,经蒸发结晶,最后得到固体的质量为35.1g,试计算:
(1)A气体在标况下的体积是_____________L
(2)固体中Na2O与Na2O2的物质的量之比是___________:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
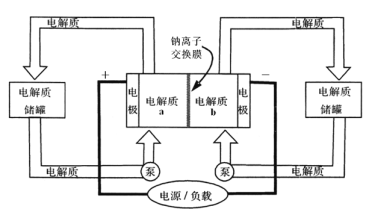
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
(1)理论上需要多少克MnO2参加反应?_____________
(2)参加反应的HCl的物质的量为多少?_____________
(3)被氧化的HCl的物质的量为多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
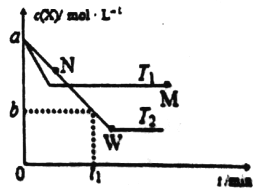
A. M点的正反应速率v正大于N点的逆反应速率v逆
B. T2下在0—t1min时间内v(Y)=a-b/t1mol·L-1·min-1
C. 该反应进行到M点放出的热量大于进行到W点放出的热量
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20g质量分数为14%的KNO3溶液与30g质量分数为24%的KNO3溶液混合,得到的密度为1.26 g/mL的混合溶液。计算:
(1)混合后溶液的质量分数_______________________。
(2)混合后溶液的物质的量浓度________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com