
【题目】写出下列反应的化学方程式
(1)氯气和水反应:_____________________________ ;
(2)Ca(ClO)2+CO2+H2O:___________________________ ;
(3)工业上制取氯气:________________________________ ;
(4)工业制漂白粉:__________________________________。
【答案】Cl2+H2O=HCl+HClO Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2NaOH+H2↑+Cl2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)氯气和水反应生成盐酸和次氯酸:Cl2+H2O=HCl+HClO;
(2)碳酸的酸性比次氯酸强,Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(3)工业上用电解饱和食盐水制取氯气:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(4)工业用氯气和消石灰反应制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.2mol N2和0.6mol H2混合充分反应后,转移的电子数目为1.2 NA
C. 0.1 mol9038Sr原子中含中子数为3.8NA
D. 1L1 mol·L-1 Ca(ClO)2溶液中含ClO-的数目等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用双离子交换膜电解法可以处理含NH4NO3的工业废水,原理如图所示,下列叙述错误的是
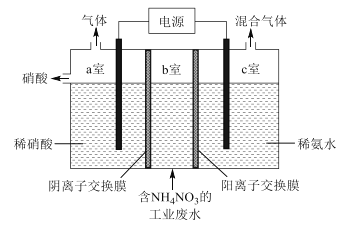
A. NH4+由b室向c室迁移
B. c室得到的混合气体是NH3和H2
C. 阳极反应式为2H2O -4e-=O2+4H+
D. 理论上外电路中流过1mol电子,可处理工业废水中0.5mol NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末由Na2O与Na2O2组成,将其分成等量的二份,一份与足量的CO2气体作用,发现该固体质量增加了10.0g,同时生成了新的气体A;另一份溶于过量的盐酸后,经蒸发结晶,最后得到固体的质量为35.1g,试计算:
(1)A气体在标况下的体积是_____________L
(2)固体中Na2O与Na2O2的物质的量之比是___________:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
(1)理论上需要多少克MnO2参加反应?_____________
(2)参加反应的HCl的物质的量为多少?_____________
(3)被氧化的HCl的物质的量为多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列空白:
(1)9gNH4+的物质的量为___,其中含电子的数目为___。(用NA表示)
(2)同温同压下:同体积的氨气和甲烷气体的质量比为___,同质量的氨气和甲烷气体的体积比为___。
(3)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为___。
(4)某无土栽培营养液中含有NH4+、Cl-、 K+、 SO42-,测得含0.6mol/LNH4+、0.5mol/LCl-、0.5mol/LK+,则SO42-的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下lmolCH3OH与02发生反应时,生成CO、CO2或HCHO的能量变化图[反应物02(g)和生成物H20(g)略去]。
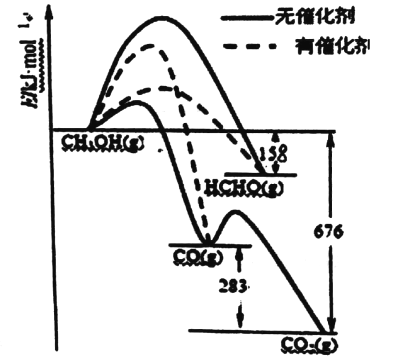
①写出1moLHCHO生成CO的热化学方程式:_______________。
②CH3OH与02在有催化剂作用下反应,产物中HCHO比率大大提高的原因是______________。
(2)—定温度下,将N2H4与N02以体积比为1:1置于10 L定容容器中发生反应 2N2H4(g)+2N02(g)![]() 3N2(g)+4H20(l) △H<0。下列能说明反应达到平衡状态的是______________。
3N2(g)+4H20(l) △H<0。下列能说明反应达到平衡状态的是______________。
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与N02体积比保持不变
d.体系压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com