
【题目】按要求完成下列空白:
(1)9gNH4+的物质的量为___,其中含电子的数目为___。(用NA表示)
(2)同温同压下:同体积的氨气和甲烷气体的质量比为___,同质量的氨气和甲烷气体的体积比为___。
(3)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为___。
(4)某无土栽培营养液中含有NH4+、Cl-、 K+、 SO42-,测得含0.6mol/LNH4+、0.5mol/LCl-、0.5mol/LK+,则SO42-的物质的量浓度为___。
【答案】0.5mol 5NA(或3.01×1024) 17:16 16:17 80g/mol 0.3mol/L
【解析】
(1)9gNH4+的物质的量为![]() 0.5mol,1个NH4+含有10个电子,其中含电子的数目为0.5mol×10 ×NA=5NA。
0.5mol,1个NH4+含有10个电子,其中含电子的数目为0.5mol×10 ×NA=5NA。
(2)根据阿伏伽德罗定律,同温同压下:同体积的氨气和甲烷气体的物质的量相等,设物质的量均为nmol,质量比为(nmol×17g/mol): (nmol×16g/mol)= 17:16,同质量的氨气和甲烷气体,设质量为mg,则物质的量分别是![]() 、
、![]() ,根据阿伏伽德罗定律,同温同压下,气体的体积比等于物质的量比,所以体积比为
,根据阿伏伽德罗定律,同温同压下,气体的体积比等于物质的量比,所以体积比为![]() :
:![]() =16:17。
=16:17。
(3)24克A和40克B恰好完全反应生成0.4molC和32克D,根据质量守恒,生成C的质量是24g+40g-32g=32g,则C的摩尔质量为![]() g/mol。
g/mol。
(4)某营养液中含有NH4+、Cl-、 K+、 SO42-,根据电荷守恒, 0.6mol/L ×1+0.5mol/L×1=0.5mol/L×1+2c(SO42-),c(SO42-)= 0.3mol/L。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是( )
A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
C.将饱和氯化铁溶液滴入沸水中得到红褐色分散系:FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
D.向CuO粉末中加入碳粉加热得到红色固体:2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
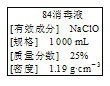
(1)该“84消毒液”的物质的量浓度约为___ mol·L-1。(取整数)
(2)某同学取100 mL 该“84消毒液”,稀释100倍后用于消毒,稀释后的溶液中c(Na+)=_____ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式
(1)氯气和水反应:_____________________________ ;
(2)Ca(ClO)2+CO2+H2O:___________________________ ;
(3)工业上制取氯气:________________________________ ;
(4)工业制漂白粉:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是

A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是

A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
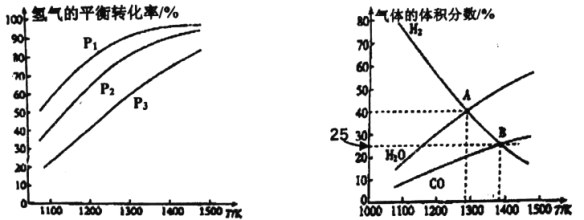
(a)不同压强下温度与H2平衡转化率的关系 (b)0.1MPa下温度与平衡时气体成分的关系
(1)由图(a)可知,该反应△H_______0(填“>”或“<”),p1、p2、p3由大到小的顺序为_______;
(2)由图(b)可知,B点时H2的平衡转化率为_______;
(3)A点对应的平衡常数K=_______(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示,回答下列问题:

(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
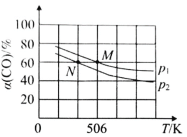
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com