
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
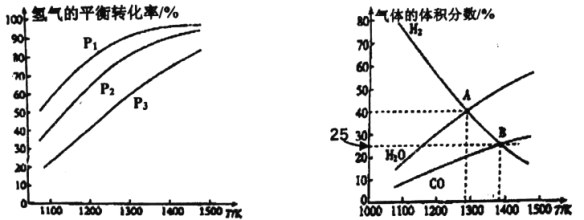
(a)不同压强下温度与H2平衡转化率的关系 (b)0.1MPa下温度与平衡时气体成分的关系
(1)由图(a)可知,该反应△H_______0(填“>”或“<”),p1、p2、p3由大到小的顺序为_______;
(2)由图(b)可知,B点时H2的平衡转化率为_______;
(3)A点对应的平衡常数K=_______(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】> p1<p2<p3 66.7% 4×10-4
【解析】
(1)升高温度平衡向吸热反应方向移动,增大压强平衡向气体总物质的量减小的方向移动;
(2)根据三段式求氢气的转化率;
(3)图1中A点氢气和水蒸气的体积分数相等,均为40%,而由反应方程式可知一氧化碳的体积分数为水蒸气的一半,即为20%,说明氢气、一氧化碳、水蒸气的物质的量之比为2:1:2,由此根据表达式求Kp。
(1)升高温度平衡向吸热反应方向移动,由图像(a)可知升高温度,氢气的转化率增大,说明平衡正向移动,正反应为吸热反应,即该反应的△H>0,增大压强平衡向气体总物质的量减小的方向移动,对MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)可知,增大压强平衡逆向移动,氢气的转化率降低,则由图像(a)可知p1<p2<p3,故答案为:>;p1<p2<p3。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)可知,增大压强平衡逆向移动,氢气的转化率降低,则由图像(a)可知p1<p2<p3,故答案为:>;p1<p2<p3。
(2)由图(b)可知,B点时H2的体积分数为25%,设起始时氢气的物质的量为1mol,此时氢气的转化率为α,则
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)
起始(mol) 1 0 0
变化(mol) α 0.5α α
平衡(mol) 1-α 0.5α α
1-α/(1+0.5α)=0.25,解得α=66.7%,即b点时氢气的平衡转化率为66.7%,故答案为:66.7%。
(3)图1中A点氢气和水蒸气的体积分数相等,均为40%,而由反应方程式可知一氧化碳的体积分数为水蒸气的一半,即为20%,说明氢气、一氧化碳、水蒸气的物质的量之比为2:1:2,Kp=(2/5×0.1)4(1/5×0.1)2/(2/5×0.1)4=4×10-4,故答案为:4×10-4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室需要750 mL 0.16 mol·L-1的NaCl溶液,有如下操作步骤:
A. 把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解,冷却至室温
B. 继续向容量瓶中加蒸馏水至液面距刻度线以下1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
C. 用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶
D. 把A所得溶液小心转入一定容积的容量瓶中
E. 将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)简述容量瓶使用前必须进行的操作________________________________
(2)操作步骤的顺序为____________________(填序号)。
(3)实验室有如下规格的容量瓶:a.100 mL,B. 250 mL,C. 500 mL,d. 1000 mL,本实验选用__________(填序号)。
(4)本实验用到的基本实验仪器除容量瓶、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还必须用到的仪器有____________,实验中玻璃棒的作用是_________________。
(5)本实验需用托盘天平称取NaCl晶体的质量是___________g。
(6)误差分析(填“偏高”“偏低”或“无影响”):
A. 某同学试验时未洗涤烧杯:____________。
B. 某同学观察液面的情况如图所示:____________。

C. 称取的食盐中混有Na2CO3杂质:___________。
(7) 已知所得溶液密度为1.04 g/mL,则所得溶液的质量分数为:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列空白:
(1)9gNH4+的物质的量为___,其中含电子的数目为___。(用NA表示)
(2)同温同压下:同体积的氨气和甲烷气体的质量比为___,同质量的氨气和甲烷气体的体积比为___。
(3)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为___。
(4)某无土栽培营养液中含有NH4+、Cl-、 K+、 SO42-,测得含0.6mol/LNH4+、0.5mol/LCl-、0.5mol/LK+,则SO42-的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法中正确的是
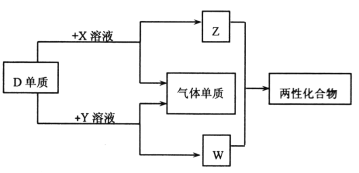
A. 对应的简单离子半径:C>D>B
B. D、E形成的化合物为含有极性共价键的共价化合物
C. 电解C、E形成的化合物水溶液,可生成C、E对应的单质
D. 由A、B、E形成的化合物都含有共价键,溶液都呈强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下lmolCH3OH与02发生反应时,生成CO、CO2或HCHO的能量变化图[反应物02(g)和生成物H20(g)略去]。
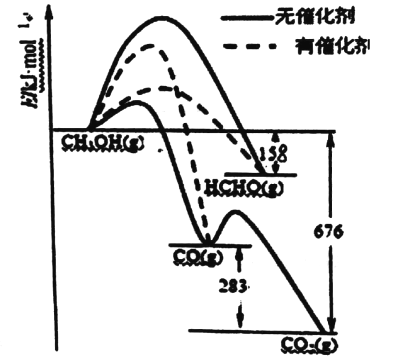
①写出1moLHCHO生成CO的热化学方程式:_______________。
②CH3OH与02在有催化剂作用下反应,产物中HCHO比率大大提高的原因是______________。
(2)—定温度下,将N2H4与N02以体积比为1:1置于10 L定容容器中发生反应 2N2H4(g)+2N02(g)![]() 3N2(g)+4H20(l) △H<0。下列能说明反应达到平衡状态的是______________。
3N2(g)+4H20(l) △H<0。下列能说明反应达到平衡状态的是______________。
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与N02体积比保持不变
d.体系压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)画出S2-结构示意图:___。
(2)某种核素质量数37,中子数20,其原子符号:___。
(3)某金属氯化物MCl240.5g中含有0.6molCl-,则M的摩尔质量为___。
(4)100mL0.25mol/LBaCl2溶液中Cl-的物质的量浓度为___;若将上述溶液稀释至500mL,Cl-的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X的原子质量数为A,含N个中子,它与![]() 原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com